
【题目】大理石广泛存在于自然界,某种大理石除主要成分![]() 外,还有少量的硫化钙。甲和乙两位同学用这种大理石和稀盐酸反应分别并展以下探究。
外,还有少量的硫化钙。甲和乙两位同学用这种大理石和稀盐酸反应分别并展以下探究。
(查阅资料)资料一:在常温下,测的浓度均为a%的下列5种溶液的pH大小情况:
溶质 |
|
|
|
|
|
pH | 小→大 | ||||
A ![]()
B ![]()
C ![]()
D ![]()
资料二:常见干燥剂有①浓硫酸②无水氯化钙③碱石灰④生石灰
(实验探究)甲同学为了得到纯净的二氧化碳,设计了如下装置,请你

(1)制备的![]() 气体中,可能含有的杂质是___________;
气体中,可能含有的杂质是___________;
(2)上述装置中,A是_______溶液,饱和NaHCO3溶液可以吸收____;
(3)上述装置中,B物质可能是___________(写名称);
(4)用这个实验得到的气体测定![]() 的相对分子质量,如果B物质失效,测定结果_______(填“偏高”、“偏低”或“不受影响”);
的相对分子质量,如果B物质失效,测定结果_______(填“偏高”、“偏低”或“不受影响”);
(5)乙同学为了计算这种大理石中含碳酸钙质量分数,进行了如下定量实验:
实验步骤 | I.将适量盐酸加入烧杯中并称重 | II.称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | III.待反应完全后,称重 |
实验图示 |
| ||
实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
乙同学通过分析计算,得出结论:该实验中生成的二氧化碳的质量是4.4g,大理石样品纯度为83.3%。请你评价他的结论是否正确________(填“正确”或“错误”,并简述理由) __________。
【答案】硫化氢、氯化氢和水蒸气 硫酸铜 氯化氢气体 无水氯化钙 偏高 错误 大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,该方法把生成的气体全部作为二氧化碳,使碳酸钙质量偏大
【解析】
(1)根据题意可知大理石中含有少量硫化钙,资料一中有信息,加入盐酸后可能与盐酸反应生成硫化氢气体,故生成的二氧化碳气体中可能含有硫化氢、氯化氢和水蒸气;
( 2)根据资料一中的信息,硫化氢可以与硫酸铜溶液反应生成硫化铜沉淀,因此可以用硫酸铜溶液除去硫化氢杂质,A是硫酸铜溶液,饱和NaHCO3溶液可以吸收氯化氢杂质;
(3)B装置为球形干燥管,盛装固体干燥剂,是为了除去水蒸气,但是选择的干燥剂不能与二氧化碳反应,因此可以选择②无水氯化钙,不能选择③碱石灰和④生石灰;
(4)结合以上分析,若氯化钙失效会使水分干燥不彻底,使二氧化碳中混有水蒸气,使质量偏大,质量越大,相对分子质量越大,测定结果偏高;
(5)该同学是将减少的质量![]() ,当成二氧化碳的质量来计算碳酸钙的质量的,根据反应方程式
,当成二氧化碳的质量来计算碳酸钙的质量的,根据反应方程式![]() ,计算出碳酸钙的质量为10g,则大理石样品纯度为
,计算出碳酸钙的质量为10g,则大理石样品纯度为![]() ,已知大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,该方法把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,他的结论是错误的。
,已知大理石中含有硫化物,硫化物与盐酸反应会生成硫化氢气体逸出,该方法把生成的气体全部作为二氧化碳,使碳酸钙质量偏大,他的结论是错误的。


科目:初中化学 来源: 题型:
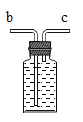
【题目】如图是实验室常见的制取气体的装置:

(1)写出仪器名称:①_____③_____④_____
(2)下列反应都能生成氧气,其中不宜用于实验室制取氧气的是_____(填字母序号)。
A加热高锰酸钾 B常温下过氧化氢溶液和二氧化锰混合反应
C利用植物光合作用 D电解水
(3)实验室采用高锰酸钾制取氧气时,应选择的发生装置是_____(填序号)。加热时试管口应向下倾斜的原因是_____。用高锰酸钾制取氧气时,该发生装置的试管内还应放入_____。
(4)实验室采用过氧化氢溶液制取氧气时,应选择的发生装置是_____。它与采用装置A制取氧气时比较,优点是_____(写出一条即可)。组装好仪器后首先应该进行的操作是_____。
(5)上图中收集氧气可以选择装置_____。如果用向上排空气法收集氧气,验满的操作是_____。如果用如图所示的集气瓶收集氧气(瓶内装满水),则进气口为_____(填相应字母)。
(6)下列关于氧气的性质的叙述中,不正确的是_____。
A通常状态下,氧气是无色无味的气体,在低温高压下可以变为液体或固体
B水生动物可在水下生存是因为氧气易溶于水
C氧气是可燃物燃烧的催化剂
D通常情况下氧气与氮气不能发生化学反应
(7)氨气(NH3)是一种极易溶于水的气体,实验室常用加热氯化铵(固体)和碱石灰(固体)的方法制取氨气,制备氨气应选的发生装置是(填序号,下同)_____,要想收集氨气,最好选用的收集装置是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)读取量筒里液体体积时,视线与_____
(2)向试管内滴加液体时,胶头滴管应不能____。
(3)酒精灯在使用过程中两个禁止①_____;②_____
(4)向竖直的试管加入块状固体造成的后果是_____
(5)下图操作有几处错误,请改正:

_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示:

其主要反应原理如下:
①4FeWO4+4Na2CO3+O2![]() 4Na2WO4+2Fe2O3+4CO2
4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓)=H2WO4+2NaCl
③H2WO4![]() H2O+WO3
H2O+WO3
④3H2+WO3 ![]() W+3H2O
W+3H2O
下列说法不正确的是( )
A. 反应③属于分解反应
B. 反应①②③④的产物都有氧化物
C. 反应①④中有元素的化合价发生改变
D. 为加快反应的速率,可将黑钨矿石碾成粉末
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(![]() )为黑色固体。
)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:![]() .
.
(进行实验)
实验l:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1-1 | 1-2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1-2装置进行实验。
序号 | 本炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2-1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2-2 | 1:10 | 混有很少量黑色物质 | |
2-3 | 1:11 | 混有极少量黑色物质 | |
2-4 | 1:12 | 无黑色物质 | |
2-5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)实验1-2中,证明![]() 生成的方程式是_____。
生成的方程式是_____。
(2)实验1的目的是_____。
(3)实验2的结论是_____。
(反思与评价)
(4)实验2没有进行质量比为1:14的实验,理由是_____。
(5)为检验2-4的红色固体中是否含![]() ,所需试剂是_____。
,所需试剂是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据报道,科学家在深海发现了一种外表象冰的固态物质,这种物质的成分是甲烷水合物![]() 称为可燃冰。通常状况下,这种物质不稳定、易分解、易燃,在低温或高压下呈固态。其储量超过煤和石油的总储量,是很有前途的待开发能源。
称为可燃冰。通常状况下,这种物质不稳定、易分解、易燃,在低温或高压下呈固态。其储量超过煤和石油的总储量,是很有前途的待开发能源。
(1)请你分析可燃冰作为能源有什么优点?___________(答2点)
(2)测得这种晶体的结构为平均每46个水分子建8个笼,每个笼中容一个甲烷分子或一个游离的水分子,若每8个笼容有6个甲烷和2个水分子,则在这种晶体中甲烷与水的分子个数比是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将等质量的镁、铁、锌分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H2的质量与反应时间的关系如图所示.根据图中的信息,作出的判断不正确的是( )

A.图线X表示镁的反应情况
B.铁消耗的稀盐酸的质量最大
C.镁、锌一定过量,铁可能反应完
D.镁一定过量,锌、铁可能反应完
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包固体粉末,由![]() 、
、![]() 、
、![]() 、
、![]() 和NaOH中的三种物质组成。为确定其成分,进行如下实验:
和NaOH中的三种物质组成。为确定其成分,进行如下实验:
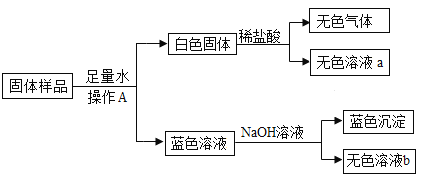
(1)写出生成无色气体的化学反应方程式________________;
(2)在上述实验基础上,补充恰当的实验,即可确定这包固体粉末的成分。需要充实验的具体操作是________________________。
(3)请设计实验验证加入的NaOH恰好适量,写出具体的操作步骤和依据的现象________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】I、如图测所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题:
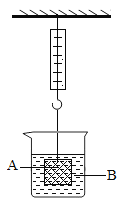
(1)若A为铁块,B为稀硫酸,则将A放入B中,过一会儿,弹簧秤的读数将(填 “变大”、“变小”或“不变”,下同)____;
(2)若A为铁块,B为硫酸铜溶液,则将A放人B中,过一会儿,弹簧秤的读数将______。
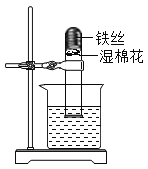
II、(1)如图所示,试管底部有螺旋状的光亮的铁丝,把试管倒插入水中,放置一周后,观察到铁丝表面有______生成,试管内的水面将_______,产生以上现象的原因是_______。
(2)某废液中含有HCl、FeCl2和CuCl2,要从中全部回收金属铜。某化学兴趣小组的同学先加入过量的铁粉,充分反应后过滤,滤渣中含有_______,如果想用化学方法继续实验得到金属铜,请写出简要步骤(包括加入试剂和操作方法)______
(3)现有铁片、铜片、硝酸汞溶液和盐酸几种物质,预确定Fe、Cu、Hg、H的活动顺序,有如下三种方案:
A Fe+HCl;Hg(NO3)2+Fe;Cu + HCl B Fe + HCl;Cu+HCl;Cu+Hg(NO3)2
C Fe+HCl;Fe +Hg(NO3)2;Cu+Hg(NO3)2
试评价这三种方案:①最差的方案是______,理由是_______;
②最好的方案是______,理由是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com