
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”。其标签如图所示,某化学兴趣小组对一包久置的“504双吸剂”固体样品产生浓厚的兴趣,设计实验进行探究。

【提出问题】:久置固体的成分是什么?
【查阅资料】:铁与氯化铁溶液在常温下发生反应:Fe+2FeCl3=3FeCl2
打开固体包装观察:部分固体呈黑色,部分固体呈白色,另有少量红棕色的块状固体。
【作出猜想】:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
其中可能含有Fe2O3的依据是________________________________。
【实验探究】:甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量久置固体于试管中,滴加足量的蒸馏水,搅拌 | 固体溶解,试管外壁发烫 | 固体中一定含有_________ |
(2)过滤,在滤液中滴加无色酚酞溶液 | 溶液变红色 | 固体中一定含有氢氧化钙 |
(3)取滤渣放入试管中,滴加足量的______________ | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有________, 一定不含氧化铁 |
【实验质疑】:乙同学认为甲同学在实验中得出 “一定不含氧化铁”的结论是错误的,理由是____________。你认为甲同学哪一步实验操作得出的结论也不合理:____________,理由是______(用化学方程式表示)。
【继续探究】乙同学另取久置的固体进行实验探究:
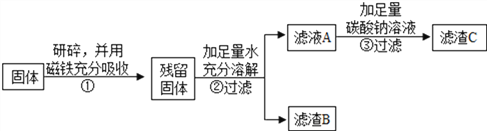
乙同学对滤渣B进行探究:
实验操作 | 实验现象 | 实验结论 |
取滤渣B于试管中,滴加足量的稀盐酸,并将气体通入澄清石灰水 | 固体逐渐消失、______、 有气泡冒出、___________ | 固体中一定含有CaCO3和Fe2O3。写出Fe2O3和稀盐酸反应的化学方程式:________________ |
【计算得出结论】:
如上述实验流程,乙同学现取5g久置固体研碎,用磁铁吸引,得残留固体3g,加足量水充分溶解过滤,得滤渣B的质量为1.8g。在滤液A中加足量碳酸钠溶液后过滤得滤渣C的质量为2g。请计算:
(1)滤液A中含氢氧化钙的质量为______________。(写出计算过程)
(2)通过计算,得出残留固体的成分:__________________。(写出计算过程)
【答案】 固体中有红棕色固体 氧化钙与水反应是强放热的反应,因为固体溶解,试管外壁发烫,故一定有氧化钙 稀盐酸 铁 氧化铁与稀盐酸反应生成氯化铁,氯化铁又与铁反应生成浅绿色的氯化亚铁 操作2 CaO+ H2O= Ca(OH)2 溶液变为黄色 澄清石灰水变浑浊 Fe2O3+ 6HCl== 2FeCl3+ 3H2O 1.48g Fe2O3、CaO、Ca(OH)2和CaCO3
【解析】(1)由于固体中含有少量红棕色的块状固体,故可能含有Fe2O3;
(2)氧化钙与水反应是强放热的反应,因为固体溶解,试管外壁发烫,故一定有氧化钙;
(3)滤渣中加入稀盐酸后,固体溶解,有氢气生成,溶液变为浅绿色,故滤渣中一定有铁;可能含有氧化铁,理由是氧化铁与稀盐酸反应生成氯化铁,氯化铁又与铁反应生成浅绿色的氯化亚铁,故可能含有氧化铁;操作2中滴入酚酞溶液变红,不一定有氢氧化钙,因为氧化钙与水反应生成氢氧化钙也会使酚酞变红,该反应的方程式为CaO+ H2O= Ca(OH)2;
(4)由于铁可以被磁铁吸引,故可以用磁铁分离出铁粉;取残留的固体加入适量的稀盐酸,固体减少,有气泡冒出,溶液变为黄色,证明固体中一定有氧化铁,发生的反应方程式为Fe2O3+ 6HCl== 2FeCl3+ 3H2O
(5)设滤液A中氢氧化钙的质量为x
Na2CO3+ Ca(OH)2= CaCO3↓+ 2NaOH
74 100
x 2g
![]() =
=![]() 求得x=1.48g
求得x=1.48g
滤渣B于试管中,滴加足量的稀盐酸,并将气体通入澄清石灰水,有气泡冒出,说明一定有碳酸钙,有黄色溶液出现,说明一定有氧化铁,由题可知,混合物中一定有氧化钙,氧化钙可以与水反应生成氢氧化钙,溶于水的物质的质量和为3g-1.8g=1.2g,假设1.2g的物质全是氧化钙,设1.2g的氧化钙与水反应生成氢氧化钙的质量为y
CaO+ H2O= Ca(OH)2
56 74
1.2 y
![]() =
=![]() 求得y=1.59g,1.59g
求得y=1.59g,1.59g![]() 1.48g,故原混合物中有氧化钙和氢氧化钙,故残留固体的成分是Fe2O3、CaO、Ca(OH)2和CaCO3;
1.48g,故原混合物中有氧化钙和氢氧化钙,故残留固体的成分是Fe2O3、CaO、Ca(OH)2和CaCO3;


科目:初中化学 来源: 题型:
【题目】下列图象与对应实验不符合的是
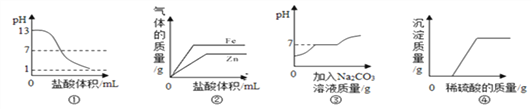
A. 图①表示向pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸
B. 图②表示向等质量的锌、铁粉末中分别滴加足量相同浓度的稀盐酸
C. 图③表示向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液
D. 图④表示向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知草酸(H2C2O4)加热时在浓硫酸的作用下会发生分解反应,某化学兴趣小组对其分解产物进行了如下探究.
(提出猜想)
(1)分解产物是一氧化碳和水蒸气的混合物.
(2)分解产物是二氧化碳和水蒸气的混合物.
(3)分解产物是一氧化碳、二氧化碳和水蒸气的混合物.
你认为合理的猜想是 _________(选填序号),依据是_________。
(查阅资料)
(1)浓硫酸具有脱水性,可以将有机物中的氢、氧元素按水的组成脱去.
(2)白色的无水硫酸铜遇水会变为蓝色.
(3)碱石灰是固体氢氧化钠和氧化钙的混合物.
(进行实验)为了检验草酸的分解产物的成份,小组同学将草酸的分解产物通过下图所示的装置(部分夹持仪器已略去).
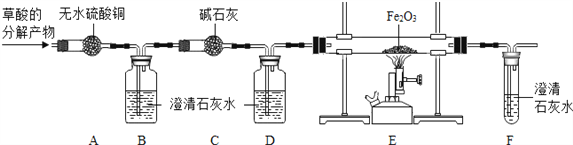
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,证明草酸分解产生了________________ 。
(2)装置D的作用是________________ 。
(3)证明草酸分解产生了一氧化碳的现象应包括_________________.
(4)装置B中发生反应的化学方程式为___________,装置E中发生反应的化学方程式为________.
(得出结论)草酸分解的化学方程式为_________________.
(反思与评价)从环保角度考虑,上述实验的不足之处是____________ .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是前20号常见元素和粒子的相关信息,请完成下列内容。
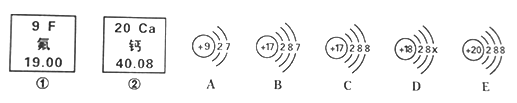
(1)图中涉及到的元素种类有__________________种;X=_____________________;
(2)请写出C粒子的符号_____________________;钙元素处于第__________周期;
(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似_______ (填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】归纳与演绎是重要的科学方法,也是常用的化学学习方法。
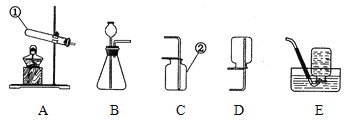
(1)写出标号仪器的名称:①_______________、②______________;
(2)我们已经学过实验室制取O2、H2、CO2三种气体的反应原理,制取与收集方法,请你归纳出实验室制取这三种气体反应的共同点___________(填序号)。
A.需要加热 B.需用催化剂 C.没有气体参加反应 D.生成的气体只有一种
(3)气体发生装置A可用来制取O2,其反应的化学方程式为________________________,可采用______装置来收集该气体。(填序号)
(4)化学上可通过多种反应得到NH3(极易溶于水,密度比空气小),例如:
a.2NH4Cl(固) + Ca(OH)2(固)△CaCl2 + 2NH3↑+ H2O
b.NH4HCO3 (固)△NH3↑+ CO2↑+ H2O c.CaO (固)+ NH3·H2O=NH3↑+ Ca(OH)2
结合以上实验装置完成下列填空: (以下所选装置均填装置序号)
我将选择反应__________(只需选填“a”、“b”或“c”中的一种)作为实验室制取NH3的反应原理,选用上图中的___________作为反应的发生装置,采用的收集装置是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“见著知微,见微知著”是化学思维方法。请根据图示回答下列问题:

(1)从宏观知微观:
①50ml水与50ml乙醇混合后,溶液体积小于100ml,微观解释为_____________________;
②某气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子有____________(填符号)
③如上图1所示:符号“Cu”能表示多种信息,如表示铜元素、金属铜单质,还能表示___________。
④从微粒的角度说明图2反应的实质是__________________________。
(2)从微观知宏观:
①如图2,微粒A、B、C、D、E中,对应单质化学性质最稳定的是_____________(填化学式),属于同种元素的是___________(填编号),C在元素周期表位于第_______周期。
②图4为某化学反应的微观示意图,则该反应的化学方程式为_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能反映相关实验过程中量的变化的图象是( )

A. 用一氧化碳还原氧化铁
B. 等质量镁、锌分别和足量等质量分数的盐酸反应
C. 镁在氧气中燃烧
D. 等质量、等质量分数的双氧水完全分解
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组的甲、乙两同学围绕Na2CO3进行了如图一所示的实验.实验结束后,丙同学把A、B两支试管中的物质倒入同一洁净的烧杯中(如图二),充分混合后发现白色沉淀明显增加,结合题目信息,回答以下问题:
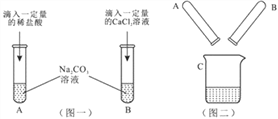
(1)甲同学的实验完成后,A试管一定有剩余的物质是_________。
(2)B试管的实验发生的化学方程式是________________。
小组同学将C中液体过滤后,对所得滤液的主要成分进行了如下探究:
【猜想与假设】实验小组的同学对滤液的成分作出了如下猜想:
猜想一:滤液中的溶质是NaCl、Na2CO3
猜想二:滤液中的溶质是_______。。
猜想三:滤液中的溶质是NaCl、CaCl2、Na2CO3
猜想四:滤液中的溶质是NaCl
【讨论与交流】通过认真讨论,小组同学排除了其中一种不合理的猜想。
(3)你认为不合理的猜想是_______,理由是______。
【进行实验】丁同学取少量滤液置于试管中,向试管中滴加一种物质,发现有无色气泡生成。
(4)你认为丁同学向滤液中滴加的物质是_________。
【实验结论】通过探究,小组同学得出了猜想一成立的结论。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:

(1)苹果酸钠盐口服液中含有的营养素有______种。每个苹果酸钠盐分子中共有_______个原子。
(2)苹果酸钠盐碳、氧元素质量比为 ______。
(3)若某病人每天食用4.68g苹果酸钠盐,则该病人每天最多吸收 ____g钠元素。
(4)药店销售一种苹果酸钠盐口服液,治疗效果非常好。该口服液的说明书如图,若某病人每天食用4.68g苹果酸钠盐,试计算该口服液中苹果酸钠盐的质量分数_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com