
金属材料在国防建设中起着重要的作用,图1为歼﹣15飞机在辽宁舰上起飞.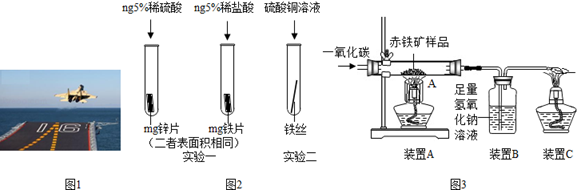
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是 、 .
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的 共同作用的结果.工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为 .
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 .
②实验二中,若出现 现象,可证明铁的活动性强于铜,该反应的化学方程式为 .
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg).
①装置A中生成铁的化学方程式为 ,装置B中发生反应的化学方程式为 .
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是 .
(1)强度大、质量轻 (2)氧气、水;Fe2O3+6HCl═2FeCl3+3H2O
(3)①选取的酸的种类不同 ②铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu
(4)①Fe2O3+3CO 2Fe+3CO2;2NaOH+CO2═Na2CO3+H2O
2Fe+3CO2;2NaOH+CO2═Na2CO3+H2O
②反应后装置A中药品的质量;测出反应前后装置B增加的质量.
解析试题分析:(1)因铝合金材质强度大、质量轻,所以铝合金可用于制造飞机的外壳;
故答案为:强度大、质量轻;
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;稀盐酸和铁锈中的氧化铁反应能生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.
故答案为:氧气、水;Fe2O3+6HCl═2FeCl3+3H2O.
(3)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
故答案为:选取的酸的种类不同;
②实验二中,若铁丝表面出现红色物质,可证明铁的活动性强于铜,该反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
故答案为:铁丝表面出现红色物质;Fe+CuSO4═FeSO4+Cu;
(4)①一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是Fe2O3+3CO 2Fe+3CO2;二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式是2NaOH+CO2═Na2CO3+H2O;
2Fe+3CO2;二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式是2NaOH+CO2═Na2CO3+H2O;
故答案为:Fe2O3+3CO 2Fe+3CO2;2NaOH+CO2═Na2CO3+H2O;
2Fe+3CO2;2NaOH+CO2═Na2CO3+H2O;
②赤铁矿样品的质量为wg,因此只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;
或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数;
故答案为:反应后装置A中药品的质量;测出反应前后装置B增加的质量.
考点:合金与合金的性质;金属活动性顺序及其应用;一氧化碳还原氧化铁;金属锈蚀的条件及其防护;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
点评:本题难度较大,掌握常见合金的优点、钢铁锈蚀的原理和除锈原理以及根据实验分析、解决问题方法是解决本题的关键.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:初中化学 来源: 题型:填空题
铜是人类最早利用的金属之一。
(1)下列铜制品中,利用金属导热性的是 (填字母序号)。 
A.铜质奖牌 B.铜导线 C.铜火锅
(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应所属基本反应类型为 。
(3)利用废旧电池铜帽(含 Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去): 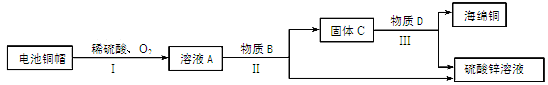
已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
2CuSO4+2H2O
①过程Ⅱ中分离操作的名称是 。
②过程Ⅲ中有气体产生,该反应的化学方程式为 。
③A~D中含铜、锌两种元素的物质有 (填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
2011年9月29日21时“天宫一号”目标飞行器在酒泉卫星发射中心发射(如下图所示),它是中国首个空间实验室,将分别与神舟八号、神舟九号、神舟十号飞船对接,从而建立第一个中国空间实验室.其结构主要包括外部壳体、实验舱、资源舱、燃料燃烧系统、对接机构和太阳能电板等,制作材料有铝、耐高温的石墨瓦、不锈钢、钛、镍和铜等等.试回答下列问题:
(1)不锈钢属于 (填“纯净物”、“混合物”).
(2)单质铜的金属活动性 单质铝的金属活动性(填“大于”、“小于”、“等于”);请设计简单实验验证(只要写出方法或用化学方程式表示) .
(3)钛是一种密度小、熔点高、耐腐蚀的优良金属,有“未来金属”的美誉,工业上冶炼钛的原理是TiCl4+4Na Ti+4NaCl;该反应属于 (填基本反应类型),反应物TiCl4中钛元素的化合价为 ,氯化钠是由 (填“分子”、“原子”或“离子”)构成的.
Ti+4NaCl;该反应属于 (填基本反应类型),反应物TiCl4中钛元素的化合价为 ,氯化钠是由 (填“分子”、“原子”或“离子”)构成的.
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片和铜片,稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序。
(1)实验前,用砂纸打磨金属片的目的是: ;
(2)根据实验目的,该同学设计了实验Ⅰ、Ⅱ两中合理的方案,如图所示: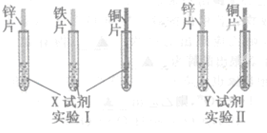
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现为青色。
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色。
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,以检验其组成为铁和铜。粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 。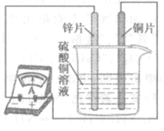
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
金属与人类生活密切相关。请分析回答下列问题:
(1)我国稀土储量居世界前列。下图是一种稀土元素铈(Ce)在元素周期表中的信息示意图,则铈原子的质子数是 ;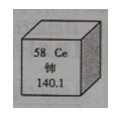
(2)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜 纯铜(填“>”、“<”或“=”);
(3)工业炼铁的反应原理是:Fe203+3C0  2Fe+3C02,该反应中体现了C0具有 性;
2Fe+3C02,该反应中体现了C0具有 性;
(4)铝制品具有很好的抗腐蚀性能,其原因是(用化学方程式表示) ;
(5)往AgN03溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中含有的金属离子是 (写出所有存在的可能组合)。
查看答案和解析>>
科目:初中化学 来源: 题型:问答题
(1)金属资源面临枯竭,保护金属资源的有效途径之一就是回收再利用,请说出回收废旧金属的好处.(答一点即可)
(2)除回收再利用外,你还知道保护金属资源的有效途径有哪些?(答两点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:问答题
(7分)人类的生产、生活离不开金属。
(1)地壳中含量最高的金属元素是 。
(2)用铜制电线主要是利用铜具有良好的延展性和 性。
(3)将生锈的铁片放入足量稀硫酸中,发生置换反应的化学方程式为 。
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤渣中滴加稀硫酸,无气泡产生。则滤渣中的金属是 ,滤液中溶质的组成是 (写出所有可能)。
(5)将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、溶质的质
量分数相同的稀盐酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲
线如图所示。下列说法正确的是 (填字母序号)。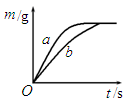
| A.消耗两种金属的质量相等 |
| B.两烧杯中金属都没有剩余 |
| C.两烧杯中稀盐酸都没有剩余 |
| D.曲线a表示锌和稀盐酸的反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)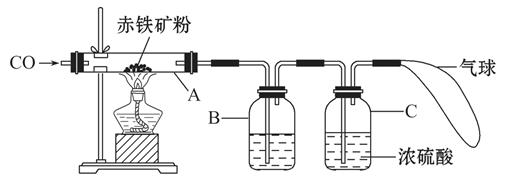
(1)甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是 浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量 得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水), (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
| 方案 | 优 点 |
| 甲组 | |
| 乙组 | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
铬(Cr)是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性,常用来镀在其他金属的表面上,铜、铬、锰、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对Cr(铬)、Al、Cu的金属的活动性顺序进行探究,过程如下:
(1)[作出假设]对三种金属的活动性顺序提出三种可能的假设是:
①Cr>Al>Cu②Al>Cr>Cu③Cr>Cu>Al
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象,记录以下:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com