【答案】
分析:(1)加热高锰酸钾制取氧气时,随着高锰酸钾的不断分解,固体颗粒逐渐变小而会随气体进入导管;为防止小颗粒进行导管,通常在试管口放一团棉花,过滤气体中的小颗粒;
(2)装置C为向上排空气收集气体,适用于密度大于空气的气体的收集;装置D为排水法收集气体,适用于不溶或难溶于水的气体的收集;装置E为向下排空气收集气体,适用于密度小于空气的气体的收集;
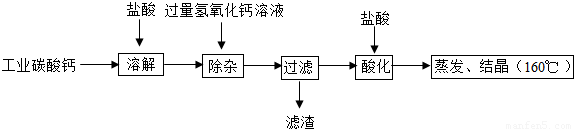
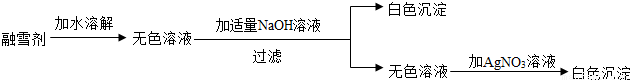
(3)无分酚酞试液遇碱性溶液变红色,遇酸性或中性溶液都不变色;反应后所得溶液为氢氧化钙溶液,呈碱性;
不溶于水的碳酸钙可与稀盐酸反应,放出气体二氧化碳;利用碳酸钙的这一性质,可使用稀盐酸检验固体中含有碳酸钙;
加入的稀盐酸与碳酸钙发生复分解反应,生成氯化钙、水和气体二氧化碳.
解答:解:(1)试管口放一团棉花,可以过滤掉混在气体中的小颗粒,防止高锰酸钾粉末进入导管;高锰酸钾在加热条件下能分解生成锰酸钾、二氧化锰和氧气,化学方程式为2KMnO
4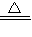
K
2MnO
4+MnO
2+O
2↑;
故答案为:防止加热时高锰酸钾粉末进入导管;2KMnO
4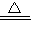
K
2MnO
4+MnO
2+O
2↑;
(2)根据氢气的密度小于空气且难溶于水的性质,收集氢气时可采取向下排空气法或排水法;
故答案为:DE;
(3)根据过氧化钙与水反应生成氢氧化钙和氧气,反应后的溶液为氢氧化钙溶液呈碱性,可使无色酚酞试液变成红色;
故答案为:酚酞;2CaO
2+2H
2O=2Ca(OH)
2+O
2↑;
前二步实验证明固体中不含氢氧化钙,而证明固体中含有碳酸钙可采取滴加稀盐酸,观察到有气体放出,可证明固体中含有碳酸钙;
故答案为:
| 实验步骤 | 实验现象 | 结论 |
| | | / |
| | | |
| 向试管中滴加盐酸 | 产生气泡,固体逐渐溶解 | |
碳酸钙与稀盐酸发生复分解反应,可生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
故答案为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O.
点评:实验室常利用含有碳酸根的碳酸盐能与盐酸反应放出二氧化碳的性质检验碳酸盐.

 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;

 备战中考寒假系列答案
备战中考寒假系列答案