
【题目】质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是____(填标号)。
A.蔗糖和水 B.氯化钠溶液和硝酸钾溶液 C.铁和氯化铜溶液
(2)在氧气中点燃红磷的实验过程,固体变化下图所示。

①从燃烧条件分析,固体质量在t1前没有发生变化的原因是_______________;
②该反应的化学方程式为___________________________;
③参加反应的氧气质量为______g。
【答案】 C 温度没有达到红磷的着火点 4P+ 5O2点燃2P2O5 8
【解析】(1). 质量守恒定律是参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。蔗糖和水、氯化钠溶液和硝酸钾溶液都不发生反应,不能用于验证质量守恒定律;铁和氯化铜溶液反应生成氯化亚铁和铜,能用于验证质量守恒定律 (2). 燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;从燃烧条件分析,固体质量在t1前没有发生变化的原因是温度没有达到红磷的着火点 (3). 磷和氧气在点燃条件下生成五氧化二磷,反应方程式为:4P+ 5O2 点燃2P2O5 (4). 五氧化二磷的质量等于参加反应的磷的质量和氧气的质量和,所以反应的氧气的质量为:14.2g-6.2g=8g


科目:初中化学 来源: 题型:
【题目】水和溶液是生活中常见的物质,请按要求回答问题。
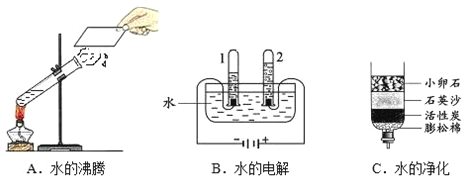
(1)图三个操作中,能够证明水是由氢、氧元素组成的是________(填序号)。 图 C 中活性炭的作用的是____________。
(2)从微观角度解释图 A 与图 B 中所发生的变化的本质不同是___________________。
(3)甲乙两种不含结晶水的固体物质的溶解度曲线如图所示。
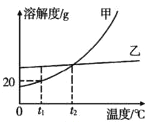
① t2℃时,甲、两种物质的溶解度比较 甲___________乙(填“>”“<”或“=”)。
② t1℃,将 50g 水加入 25g 甲物质中,充分搅拌, 可得到_________g 溶液。
③ 要使快接近饱和的乙溶液转化为饱和溶液,可采用__________方法。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NH4C1和Na2SO4的溶解度表及溶解度曲线如下,下列说法正确的是:( )
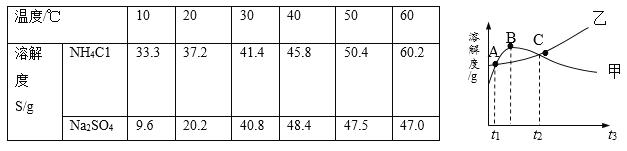
A. 甲为NH4C1
B. t2时,甲溶液的溶质质量分数一定比乙大
C. 甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D. 等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是常见固体物质的溶解度曲线,根据图示回答:
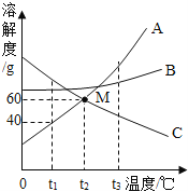
(1)t3℃时,A、B、C三种物质的溶解度由大到小的顺序为____。
(2)t1℃时,将20g A物质放入100g水中,充分溶解后所得的溶液是____(填“饱和”或“不饱和”)溶液.欲使t2℃时C物质的饱和溶液变为不饱和溶液,可采取的方法是___(任填一种方法)。
(3)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:
①水的质量 ②溶液中KNO3的质量 ③KNO3的质量分数
④30℃时KNO3的溶解度 ⑤溶液的质量
Ⅰ.在该不饱和溶液中加硝酸钾至饱和,不变的量有______(填序号,下同),
Ⅱ.将该不饱和溶液恒温蒸发至饱和,不变的量有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料,制备FeCO3和Fe2O3的一种流程如下图所示:

资料:FeCO3![]() FeO+CO2↑,4FeO+O2=2Fe2O3;
FeO+CO2↑,4FeO+O2=2Fe2O3;
FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑
下列说法正确的是
A. 反应Ⅰ需控制温度在35℃以下,原因可能是因为NH4HCO3受热易分解
B. 滤液中的溶质只有( NH4)2 SO4
C. 在空气中煅烧23.2g的FeCO3,得到Fe2O3和FeO的混合物15.2g。则生成Fe2O38.0g
D. 在空气中充分煅烧FeCO3,若煅烧时间越多,则最终所得固体的质量越小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)用相应的化学符号填空:
①氮元素___; ②最简单的有机物_______;
③三个硫酸根离子_______; ④二氧化氯中氯元素的化合价_______。
(2)选择相应物质的字母填空:
A. 熟石灰 B. 石墨 C. 纯碱 D. 碳酸钙
①可作干电池电极的是_______; ②可用作补钙剂的是_______;
③用于中和土壤酸性的是_______; ④厨房中用于洗涤油污中的“碱”是_______。
(3)写出下列化学反应的化学方程式:
①铁在氧气中燃烧:_______; ②高锰酸钾受热分解:_______;
③绿色植物的光合作用:_______;
④二氧化氮和铜加热生成氧化铜和一种空气中的主要气体:_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用的原理( 用化学方程式表示)及基本反应类型均正确的是( )
A.用赤铁矿高炉炼铁 Fe2O3+3CO高温2Fe+3CO2 置换反应
B.硫酸厂污水可用熟石灰中和处理 H2SO4+Ca(OH)2====CaSO4+H2O 复分解反应
c.加热混有二氧化锰的氯酸钾制取氧气 2KClO3 ![]() 2KCl+3O2↑分解反应
2KCl+3O2↑分解反应
D.用红磷测定空气中氧气含量 4P+5O2点燃2P2O5 氧化反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列事实说明空气中含有哪些成分?
(1)纸张在空气中燃烧_____;(2)空气是制造硝酸和氮肥的原料____;
(3)酥脆饼干在空气中放置逐渐变软_____;(4)长期暴露在空气中的澄清石灰水表面上有一层白色物质_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com