
| A. | 玉米粥6.8~8.8 | B. | 葡萄3.5~4.5 | C. | 泡菜3.0~4.0 | D. | 橘子2.9~3.5 |
科目:初中化学 来源: 题型:选择题
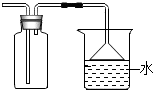 如图为某实验时收集二氧化硫气体的装置中,根据此收集装置不能推断出SO2可能具有的性质( )
如图为某实验时收集二氧化硫气体的装置中,根据此收集装置不能推断出SO2可能具有的性质( )| A. | 污染性气体 | B. | 密度比空气大 | ||
| C. | 在空气中易形成酸雨 | D. | 易溶于水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
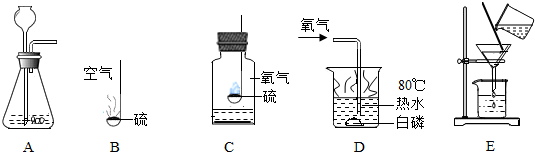
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4 $\stackrel{+BaCl_{2}}{→}$HCl | B. | CO $\stackrel{+NaOH}{→}$ Na2CO3 | ||
| C. | Cu(OH)2 $\stackrel{+NaCl}{→}$ NaOH | D. | NaNO3 $\stackrel{BaCl_{2}}{→}$ Ba(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 花的种类 | 花汁在酒精中的颜色 | 花汁在酸溶液中的颜色 | 花汁在碱溶液中的颜色 |
| 大红花 | 粉红色 | 橙色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 雏菊 | 无色 | 无色 | 黄色 |
| A. | 研磨花瓣时加入酒精是为了溶解其中的色素 | |
| B. | 在pH=10的溶液中大红花汁会变成橙色 | |
| C. | 万寿菊花汁不能用作酸碱指示剂 | |
| D. | 可用雏菊花汁来区别稀盐酸和氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金刚石不是金属材料;不饱和溶液通过一定方法变成饱和溶液,质量分数不一定增大 | |
| B. | 水银中含银元素;能到点的一定是金属材料 | |
| C. | 有发光、发热的现象的就是燃烧;能使石蕊试液变蓝的溶液,其溶质一定是碱 | |
| D. | 家用煤气有刺鼻的气味,说明一氧化碳有这种特殊气味,铅笔芯中主要含铅 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
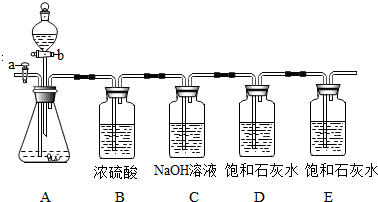
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com