8.某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究.
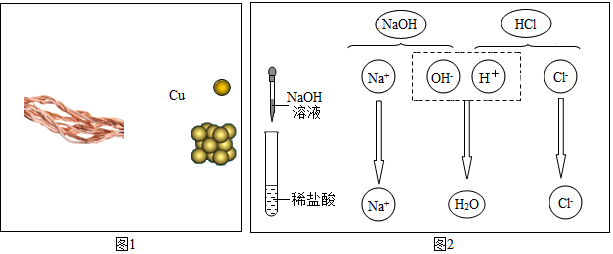
(1)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是C(选填序号).

(2)铁生锈的主要过程为:Fe$\stackrel{O_{2}、H_{2}O}{→}$ Fe(OH)
2 $\stackrel{O_{2}、H_{2}O}{→}$ Fe(OH)
3 $\stackrel{风吹日晒}{→}$Fe
2O
3•xH
2O
次要过程为:Fe $\stackrel{O_{2}、CO_{2}、H_{2}O}{→}$ FeCO
3(3)铁锈组分的确定
某铁锈成分为Fe
2O
3•xH
2O和FeCO
3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用如图装置进行实验.
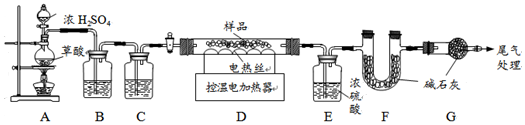
【查阅资料】Fe
2O
3•xH
2O失去水分子温度为110℃,FeCO
3在282℃分解为FeO和CO
2.温度高于400℃时铁的氧化物才能被CO还原.
①装置A中的反应为:H
2C
2O
4(草酸)$→_{△}^{浓硫酸}$CO↑+CO
2↑+H
2O.通过B、C装置可得到干燥、
纯净的CO气体,洗气瓶B中最好盛放C(选填序号).
A.浓硫酸 B.澄清的石灰水 C.氢氧化钠溶液
②现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g.则样品中FeCO
3的质量m(FeCO
3)=5.8g,x=2.
(4)在钢铁厂的实验室,同学们了解到随着温度的升高,氧化铁在还原过程中能产生其他铁的氧化物,并最终被还原成铁.下图是某种热分析仪记录的CO与Fe
2O
3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线.根据图象分析,固体质量由48.0g变为46.4g的过程中发生反应的化学方程式为3Fe
2O
3 +CO$\frac{\underline{\;400℃~500℃\;}}{\;}$2Fe
3O
4+CO
2.

(5)同学们取了10g某菱铁矿样品(主要成分为FeCO
3,杂质不参加反应),磨成粉末,加入200g足量稀硫酸,充分反应后称得剩余物的总质量为207.8g,计算该样品中FeCO
3的质量分数.(要有完整的计算过程)已知:FeCO
3+H
2SO
4═FeSO
4+H
2O+CO
2↑


 活力课时同步练习册系列答案
活力课时同步练习册系列答案