

分析 (1)向饱和食盐水中加入氨气、二氧化碳后,能够生成碳酸氢钠和氯化铵,相同条件下碳酸氢钠的溶解度小于氯化铵的溶解度,因此碳酸氢钠会析出,加热碳酸氢钠能够生成碳酸钠、水和二氧化碳,从而得到纯碱;
(2)氨气溶于水形成氨水,氨水显碱性,从而使溶液显碱性;
(3)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.
解答 解:(1)最终所得纯碱的主要成分是碳酸钠,碳酸钠的化学式是Na2CO3,碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐,碳酸钠溶于水时溶液显碱性;
故填:Na2CO3;盐;碱.
(2)在流程Ⅱ中,如果加入氨气不是为了生产氯化氨,氨气在制碱过程中的作用是使溶液显碱性,有利于吸收二氧化碳.
故填:使溶液显碱性,有利于吸收二氧化碳.
(3)碳酸氢钠受热分解的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故填:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 化学来源于生产、生活,也服务于生产、生活,要学好化学知识,为生产、生活服务.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:解答题
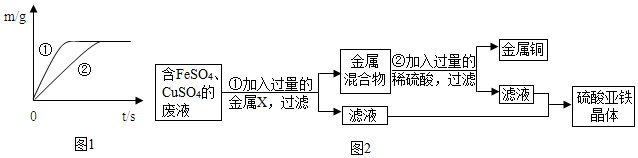
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用生石灰做食品干燥剂 | B. | 塑料经吹拉制成塑料薄膜 | ||
| C. | 用活性炭做冰箱异味吸附剂 | D. | 用稀有气体做电光源的填充气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
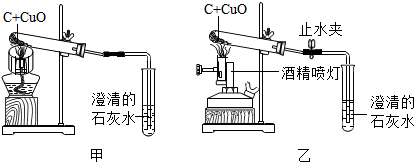
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 一 | 二 | 三 | 四 | |
| 加入黄铜样品质量/g | 1 | 2 | 3 | 4 |
| 生成氢气的质量/g | 0.02 | 0.04 | 0.05 | M |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com