
【题目】下列的各物质属于纯净物的是
A. 氢气在氧气中燃烧所得的液体 B. 碘酒 C. 合金 D. 稀硫酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】夏天的傍晚,去散步前往身上喷花露水,蚊子就不敢靠近,这一现象说明
A. 分子之间有间隙 B. 分子在不断运动
C. 分子由原子构成 D. 分子的质量较大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】控制化学反应的条件可以促进或抑制化学反应,更好地使化学反应为人类造福.
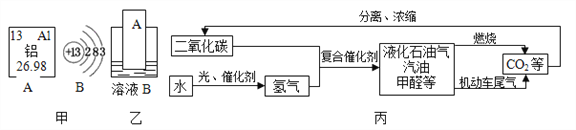
(1)元素周期表中铝元素的信息如图甲所示,其相对原子质量为______.化学反应中该原子容易______________(填“得到”或“失去”)电子;
(2)铝制品在生活中因耐用而应用越来越广泛,主要原因是__________(用化学方程式表示);
(3)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于______(填“混合物”或“纯净物”);
(4)要通过图乙实验得出铝和铜的金属活动性顺序,如果B是硫酸铜溶液,则金属A是______(填化学式),如果A是铜,则溶液B中溶质的名称是__________________;
(5)如图丙是科学家正在研究的二氧化碳循环利用技术:
①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式______________________________;
②尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质X发生反应:CO2+2X═CO(NH2)2+H2O,物质X的化学式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们利用假期外出旅游。
(1)随身携带轻便而不易碎的塑料瓶。塑料属于_________(填序号)。
①金属材料 ②天然材料 ③合成材料
(2)购买的“自热米饭”的加热原理是:生石灰与水反应能放出大量热。该反应的化
学方程式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】饮用水的净化过程一般要经过三个阶段:贮存、净化、输水.水库将雨水、江河和溪流里的水汇集贮存起来,净化时首先在水中加入沉淀剂,这些物质可以使悬浮在水中不溶性颗粒逐渐的沉降下来.如图是水的净化过程示意图,回答下列问题:
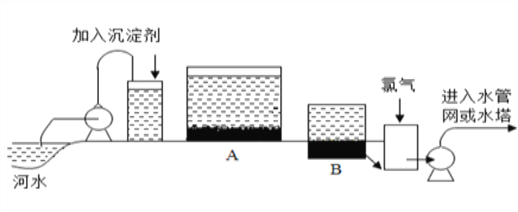
(1)常用的沉淀剂(絮凝剂)有______;
(2)若A中是小卵石和石黄沙的作用是____;在实验室进行该操作要用到玻璃棒的作用是_______;
(3)若B中是粒状活性炭,其目的是______。
(4)进入水管网或水塔中的水是否是纯净物____;理由______________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图的信息判断,下列关于铝的说法的正确(____)
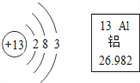
A.相对原子质量是26.982g
B.原子的中子数是13
C.在化学反应中,原子易失去电子形成Al3+
D.____________________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】韩国三星在Note7上第一次用到了铝合金做外壳,并使机壳超薄。不过,这样的外观设计却最终断送了Note7的前程,使手机充电时过热,发生燃烧而爆炸现象。
试回答:
(1)锂电池的使用是利用______能和______能的转化过程。
(2)三星Note 7使用铝合金,所利用了铝合金的优点是____(多选题)
A.光泽好、密度小 B.强度大、耐腐蚀性好 C.导电性好
(3)在高温的条件下,铝合金中的铝也会燃烧,反应的化学方程式为_________________;
(4)锂电池使用的阳极材料是钴酸锂,其化学式为LiCoO2已知锂的原子结构示意图为![]() 则钴元素的化合价是________价
则钴元素的化合价是________价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】:(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为____。
【制备研究】:(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的________。
【Na2CO3质量分数测定】:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图,装置(已知H2SO4溶液与NaN3,反应不生成气体)。

(3)装置A的作用是________。
设计的实验步骤为:
①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置C;
③关闭弹簧夹,打开分液漏斗活塞;
④再打开弹簧夹,________;
⑤再次称量装置C。
计算碳酸钠含量至少需要测定________(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因________。
【NaN3纯度测定】
精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3![]() 3N2 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
3N2 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。

(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差________(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是________。
(6)使用冷水冷凝的目的是________。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是________。
(7)常温下测得量气管读数为67.2 mL(N2的密度为(1.25 g/L),则实验中选用的量气管规格合适的是________(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com