

分析 (1)根据氧化物的定义分析;根据用赤铁矿和一氧化碳在高温条件下炼铁的反应写出反应的方程式.
(2)根据金属铁的性质进行分析解答即可.
(3)根据金属活动性顺序的具体应用对金属的活动性进行分析,依据反应的反应物生成物种类判断反应的类型;
(4)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.据此分析有关的问题.
解答 解:(1)赤铁矿石的主要成分Fe2O3、铝土矿的主要成分是Al2O3,由两种元素组成,其中一种元素是氧元素,属于氧化物;工业常用赤铁矿和一氧化碳在高温条件下炼铁,该反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故答为:(1)Fe2O3、Al2O3;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)利用铁做炊具,利用了铁的导热性;铁在与水和氧气并存时易生锈,防锈就是破坏铁生锈的条件,可以在铁栏杆表面刷漆;
故答案为:导热;氧气;刷漆.
(3)由金属活动性顺序的具体应用可知:活动性在氢前的金属可以与稀酸反应生成氢气,金属活动性强的金属可以把金属活动性比它弱的金属从其盐溶液中置换出来,所以据M+H2SO4═MSO4+H2↑ Fe+MCl2═M+FeCl2 N+FeCl2═Fe+NCl2可知:M活动性在氢前且比铁弱,N活动性在比铁强,结合金属活动性顺序表可知四种金属的活动性顺序是:N>Fe>M>Cu;
故答案为:N>Fe>M>Cu.
(4)①在金属活动性顺序中,锌>氢>铜>银,锌先与硝酸银反应生成硝酸锌和银,后与硝酸铜反应生成硝酸锌和铜,若滤液呈无色,说明滤液中无铜离子,那么硝酸银一定被反应完全,硝酸铜也被反应完全,则滤渣中一定含有的物质是Cu、Ag;
②若向滤渣中滴加稀盐酸,无明显现象,说明滤渣中无金属锌,在AgNO3和Cu(NO3)2的混合溶液中加入一定量的锌粉,锌与硝酸银反应生成硝酸锌和银,和硝酸铜反应生成硝酸锌和铜,生成的铜会与硝酸银反应生成硝酸铜和银,故滤液中所含溶质的成分可能有AgNO3、Cu(NO3)和Zn(NO3)2;Cu(NO3)和Zn(NO3)2;Zn(NO3)2;
故答案为:Ag、Cu;3.
点评 本本题难度不大,物质的性质决定物质的用途,掌握化学式的书写方法、常见化学物质的性质和用途、常见塑料的性质、防止铁生锈的措施等是正确即可解答本题.此题是一道与金属相关的考查题,解题的关键是充分理解和掌握金属活动性顺序表的意义以及其它相关的知识.


科目:初中化学 来源: 题型:选择题
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
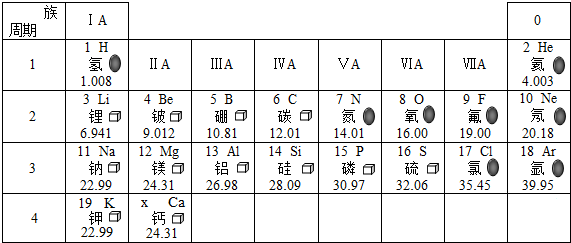
 ”相似的物质的化学式O2或N2或H2或Cl2或F2,其状态为气态;
”相似的物质的化学式O2或N2或H2或Cl2或F2,其状态为气态;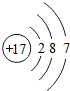 ,与氯元素在同一纵行的氟元素,其原子结构与氯相似,由此推断,氟原子在化学反应中易得电子(填“得”或“失”),其离子符号为F-,说明元素的化学性质与原子的最外层电子数关系密切.
,与氯元素在同一纵行的氟元素,其原子结构与氯相似,由此推断,氟原子在化学反应中易得电子(填“得”或“失”),其离子符号为F-,说明元素的化学性质与原子的最外层电子数关系密切.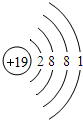 ,写出钾元素与硫酸根组成化合物的化学式为K2SO4.
,写出钾元素与硫酸根组成化合物的化学式为K2SO4.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
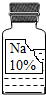 实验室有一瓶保存不当的试剂(如下图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.
实验室有一瓶保存不当的试剂(如下图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论 |
| 步骤一:取样品于试管中,滴加足量稀盐酸 | 产生大量的气泡 | 猜想①正确. |
| 步骤二:把产生的气体,通入 澄清的石灰水 | 石灰水变浑浊 |
| 探究步骤 | 预计现象 | 结论 |
| 步骤一:取样品于试管中,向其中滴加足量的氯化钙溶液并过滤 | 产生白色沉淀 | 溶液中既含Na2CO3,又含有NaOH |
| 步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酚酞遇到酸溶液变成红色 | B. | 羊毛灼烧时闻到烧焦羽毛的气味 | ||
| C. | 镁条燃烧生成氧化镁 | D. | 硫在氧气中燃烧发出淡蓝色的火焰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com