
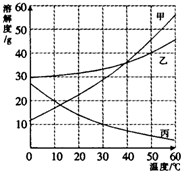
 甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:
甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源: 题型:
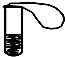 如图所示:在一试管中盛有一种无色液体,小气球中有一种常见的固体,现将气球中的固体倒入试管中,立即产生气泡,小气球立即胀大,请你猜想无色液体和气球中的固体物质可能是什么?并写出它们发生反应的化学方程式(三种猜想要选择三种不同类别的物质)
如图所示:在一试管中盛有一种无色液体,小气球中有一种常见的固体,现将气球中的固体倒入试管中,立即产生气泡,小气球立即胀大,请你猜想无色液体和气球中的固体物质可能是什么?并写出它们发生反应的化学方程式(三种猜想要选择三种不同类别的物质)查看答案和解析>>
科目:初中化学 来源: 题型:
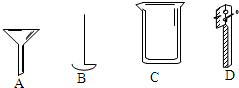 根据下列仪器,回答问题:
根据下列仪器,回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:
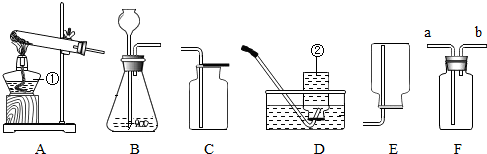
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 操作 | 现象 | 结论 |
| 呼出气体中含有氧气 | ||
| 呼出气体中含有二氧化碳 | ||
| 呼出气体中含有水蒸气 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com