
(3分)将15.8 g高锰酸钾放入试管中加热制取氧气,充分反应至不再产生气体为止。
计算:剩余固体物质的总质量是多少克?(已知:2KMnO4 ="=" K2MnO4+MnO2+O2↑)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:计算题
(7分)学过金属活动性后,秦思同学通过实验探究锌粉与硝酸亚铁和硝酸银两种盐溶液的反应。实验现象和数据如下: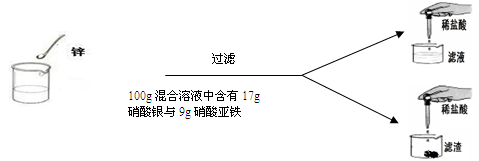
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 硝酸亚铁与硝酸银的混合溶液 | 100g | 100g | 100g | 100g |
| 锌粉 | 2g | 3.25g | m | 9.75g |
| 向滤液中加入稀盐酸后的实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 | 无明显现象 |
| 向滤渣中加入100 g稀盐酸后的实验现象 | 无明显现象 | 无明显现象 | 产生气泡,溶液变为浅绿色 | 现象与第三次相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分)为了测定某品牌小苏打样品中碳酸氢钠的质量分数,兴趣小组进行了如下图所示的实验(假设该样品中只含有氯化钠一种杂质)。
请计算:
生成CO2气体的质量;
样品中碳酸氢钠的质量分数。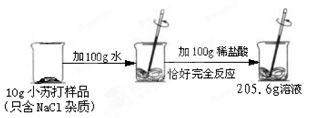
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分)黄铜(由铜和锌形成的合金)有较强的耐磨性能、可塑性好、易加工,在生活中有广泛的用途,可以制作机器零件、仪表等.某同学为了测定某黄铜屑样品的组成,分四组取样品与稀硫酸反应,其实验数据记录如下表: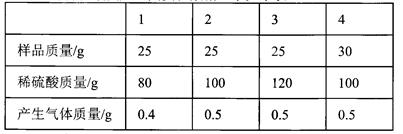
(1)通过分析上述数据可知,第 实验黄铜样品和稀硫酸恰好完全反应;
(2)黄铜合金中锌的质量为 g
(3)列式计算所用稀硫酸中硫酸的质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)硅(Si)是太阳能电池和电脑芯片中不可缺少的材料。硅生产过程中的一个重要化学反应为SiO2 + 2C 高温 Si + 2CO↑。若生产5.6 g硅,理论上需要二氧化硅(SiO2)多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
汽车尾气系统中使用催化转化器,可降低CO、NO等有毒气体的排放,其反应化学方程式为:2CO+2NO催化剂2CO2+N2,当有5.6gCO被转化时,计算同时被转化的NO的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)超市卖的纯碱产品中往往会含有少量的氯化钠,为了测定其组成,某校化学兴趣小组的同学对其进行了如下实验:
(1)用试管取适量样品,先向其中加入过量稀硝酸,再滴入适量硝酸银溶液,若观察到 ,则证明该样品中含有氯化钠。
(2)为测定该产品中碳酸钠的含量,进行如下定量实验: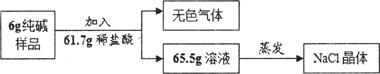
①根据质量守恒定律,该实验所得无色气体的质量是 。
②计算该6g纯碱样品中碳酸钠的质量,请写出计算过程。(计算结果精确至O.lg)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
葡萄糖是生命活动中不可缺少的物质,它在人体内能直接参与新陈代谢过程。
| | 部分性质 | 生理作用 |
| 葡萄糖 化学式: C6H12O6 | 白色结晶或颗粒状粉末,味甜;易溶于水;具有还原性,葡萄糖溶液与新制氢氧化铜悬浊液反应生成砖红色沉淀 | 葡萄糖为机体所需能量的主要来源,能促进肝脏的解毒功能,对肝脏有保护作用 |

 C6H12O7+Cu2O↓+2H2O
C6H12O7+Cu2O↓+2H2O 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com