
 儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:
儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:分析 (1)微量元素指占人体内的总重量的万分之一以下的元素,锌仅占人体总重量的百万分之三十三;由标签上化学式可知,葡萄糖酸锌分子中的碳、氢原子个数分别为12和22;
(2)根据葡萄糖酸锌中锌元素的质量即可求得锌元素的质量分数;
(3)儿童1kg体重每日需要0.5mg锌,则可计算出体重为20kg的儿童每天需要锌的质量;由每天从食物中只能摄入所需锌的一半,据此计算每天还需服该口服液的数量.
解答 解:(1)锌只占人体总重量的百万分之三十三,属于微量元素;葡萄糖锌中的碳、氢原子个数比为=12:22=6:11;
(2)每支口服液中锌的质量分数为$\frac{5mg}{10000mg}$×100%=0.05%;
(3)儿童1kg体重每日需要0.5mg锌,则体重为20kg的儿童每天需要锌的质量为0.5mg×20=10mg;每天从食物中只能摄入所需锌的一半,则每天从该口服液中摄入所需锌的质量为10mg×$\frac{1}{2}$=5mg;而每支口服液中含锌5.0mg/支,故体重为20kg的儿童每天还需服该口服液1支.
故答案为:(1)微量;6:11;
(2)0.05%;
(3)1.
点评 由标签获得重要信息如物质的化学式、组成成分、各成分的含量等等是解决标签类问题的基础.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在化学变化中分子可以分成原子 | |
| B. | 原子都是由质子、中子和电子构成 | |
| C. | 氧化物中一定含有氧元素 | |
| D. | 固体难压缩,说明固体分子间间隔很小 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
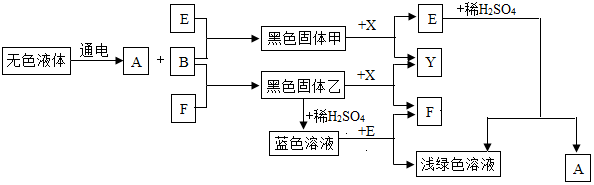
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
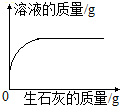 |  |  |  |
| A.一定质量的饱和石灰水中加入生石灰 | B.用酒精灯加热一定量的高锰酸钾固体 | C.向NaOH溶液中逐滴加入稀盐酸 | D.在一定量的CaCl2溶液中通入CO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
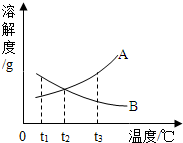 A、B两种物质的溶解度曲线如图.t3℃时,将A、B分别溶于100g水中,各自配制成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法正确的是( )
A、B两种物质的溶解度曲线如图.t3℃时,将A、B分别溶于100g水中,各自配制成饱和溶液,然后降温.试根据溶解度曲线判断,下列说法正确的是( )| A. | t3℃时,两种饱和溶液的质量分数相等 | |
| B. | 降至t2℃时,A物质的溶液仍然是饱和溶液 | |
| C. | 降至t1℃时,B物质的溶液里溶质质量分数变小 | |
| D. | 降至t1℃时,两种溶液的质量均不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com