
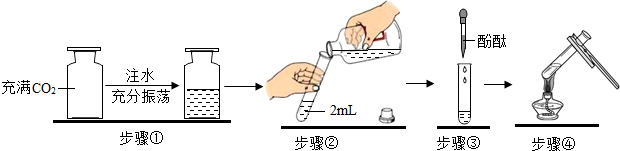
| A. | 步骤① | B. | 步骤② | C. | 步骤③ | D. | 步骤④ |
科目:初中化学 来源: 题型:选择题
| A. | 钙、铁是人体中不可缺少的常量元素 | |
| B. | 金属活动性顺序表是金属活动性的判断依据 | |
| C. | 从元素周期表中可以确定该元素在自然界中的含量 | |
| D. | 碱和盐中一定含有金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 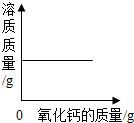 一定量的饱和石灰水中加入氧化钙 | |
| B. |  常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应 | |
| C. |  等体积,等浓度的双氧水制取氧气 | |
| D. | 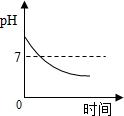 向一定量稀氢氧化钠溶液中滴入水 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
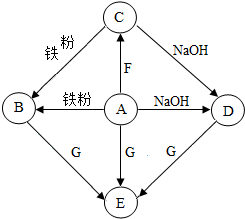 A-G是初中化学常见物质,其中,A的浓溶液挥发出刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为白色沉淀.如图是这些物质的转化关系,部分反应物、生成物及反应物条件已省略.
A-G是初中化学常见物质,其中,A的浓溶液挥发出刺激性气味的气体,从C→D的反应过程中有蓝色沉淀生成,E为白色沉淀.如图是这些物质的转化关系,部分反应物、生成物及反应物条件已省略.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
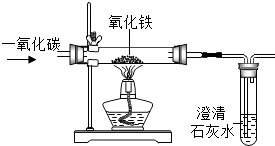 实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )
实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )| A. | 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 | |
| B. | 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 | |
| C. | 反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 | |
| D. | 为了减少空气污染,应增加尾气处理装置 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCl | 25.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
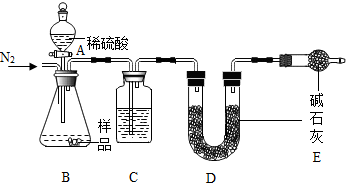
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K+、Ba2+、OH-、Cl- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | K+、OH-、Cl-、CO32- | D. | H+、Ag+、Ba2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com