

分析 (1)根据质量守恒定律和反应的化学方程式,化学变化前后原子的种类、数目不变,可以推断反应中物质X的分子构成及物质X化学式的确定;
(2)操作1和操作2为过滤操作,从而考虑玻璃棒的作用,结合溶液的酸碱性分析.
(3)氢氧化铝与盐酸反应的化学方程式,判断反应类型;
(4)步骤3中灼烧发生分解反应,根据蒸馏水确定生成物,在利用反应条件,写出该反应的化学方程式.
解答 解:
(1)由反应的化学方程式Al2O3+2NaOH═2NaAlO2+X,则:
反应前 反应后
Al原子 2 2
Na原子 2 2
O原子 5 4
H原子 2 0
根据质量守恒定律化学变化前后原子的种类、数目不变,可判断物质X的每个分子由2个H原子构成、1个氧原子构成,则物质X的化学式为H2O;
(2)操作1和操作2中均为过滤操作,用到玻璃棒,其作用是引流.滤液2的pH为10>7,显碱性;
(3)步骤2得到的氢氧化铝可以用于治疗胃酸过多,它与胃酸反应的化学方程式是 3HCl+Al(OH)3═AlCl3+3H2O,该反应符合“两种化合物相互交换成分,生成另外两种化合物”的特点,属于复分解反应.
(4)步骤3中灼烧发生分解反应,根据“除了生成氧化铝,还有一种常见的氧化物生成”,根据质量守恒定律,推测“一种常见的氧化物”为水.则该反应的化学方程式为 2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O.
故答案为:
(1)H2O;(2)引流;碱;
(3)复分解;
(4)2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O.
点评 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

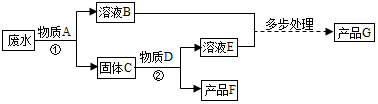
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
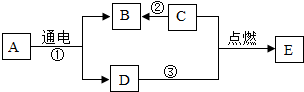 A、B、C、D、E为初中化学常见物质,其中C为世界上年产量最大的金属,它们之间的转化关系如图所示(反应条件,部分反应物和生成物已略去).
A、B、C、D、E为初中化学常见物质,其中C为世界上年产量最大的金属,它们之间的转化关系如图所示(反应条件,部分反应物和生成物已略去).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
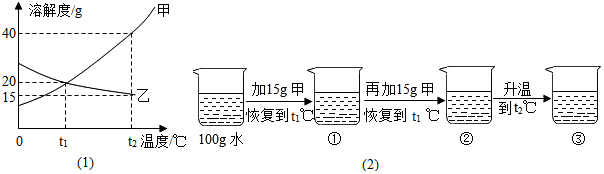
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
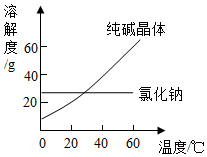 南海是我国固有领海,蕴藏着丰富的海洋资源.
南海是我国固有领海,蕴藏着丰富的海洋资源.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
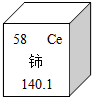 稀土元素是一类有重要用途的资源.铈(Ce)是一种常见的稀土元素,下列有关说法中错误的是( )
稀土元素是一类有重要用途的资源.铈(Ce)是一种常见的稀土元素,下列有关说法中错误的是( )| A. | 铈的原子序数是58 | B. | 铈原子中的质子数为58 | ||
| C. | 铈属于非金属元素 | D. | 铈的相对原子质量是140.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com