
【题目】质量守恒定律是自然界的普遍规律,它的发现对化学的发展做出了重要贡献。
(1)下列各组试剂中,通过称量在密闭容器内混合前后的总质量,不能验证质量守恒定律的是____(填字母)。
A.碘和酒精 B.碳酸钠粉末和少量稀盐酸
C.铁和氯化铜溶液 D.氢氧化钠溶液和硫酸铜溶液
(2)1774年,拉瓦锡用精确的定量实验研究了汞和氧气反应的质量关系。若用一定质量的汞和足量氧气充分反应,生成固体的情况如图所示,则有关反应的化学方程式为__________;参加反应的氧气质量为__________g。

(3)如图是某反应的微观示意图。
![]()
①该反应类型______(填“属于”或“不属于”)置换反应;其中化合价发生改变的元素是_____。
②已知:Cl2+2NaOH=NaCl+NaClO+H2O。氯气和熟石灰反应可以制得漂白粉,该反应的化学方程式为____________;Ca(ClO)2在空气中与二氧化碳和水反应会转化为CaCO3和HClO,该反应的化学方程式为____________。
(4)实验室取34g过氧化氢溶液和1g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为34. 2g。则所取过氧化氢溶液中溶质的质量分数是多少?______
【答案】 A 2Hg+O2![]() 2HgO 1.6g 不属于 Cl 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 5%
2HgO 1.6g 不属于 Cl 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 5%
【解析】(1). 质量守恒定律是参加反应的各物质的质量总和等于生成的各物质的质量总和;碘和酒精是溶解作用形成溶液,是物理变化,不能用于验证质量守恒定律; (2). 汞和足量氧气充分反应生成氧化汞,反应方程式为:2Hg+O2加热2HgO (3).由图可知,生成氧化汞的质量为21.7g,设参加反应的氧气的质量为x,
2Hg + O2加热 2HgO
32 434
x 21.7g
32/x=434/21.7g x=1.6g
(4). 由一中单质和一种化合物生成另一种和另一种化合物的反应叫置换反应。 (5). 单质中元素的化合价为零,化合物中元素的化合价的代数和为零, 因此可知氯元素反应前后化合价发生改变; (6). Cl2+2NaOH=NaCl+NaClO+H2O。熟石灰和盐酸生成氯化钙,和次氯酸生成次氯酸钙,氯气和熟石灰反应可以制得漂白粉,该反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (7). Ca(ClO)2在空气中与二氧化碳和水反应会转化为CaCO3和HClO,该反应的化学方程式为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO (8). 氧气的质量为34g+1g-34.2g=0.8g。 设过氧化氢溶液中溶质的质量为x,
2H2O2 MnO2 2H2O+O2↑
68 32
x 0.8g 68/x=32/0.8g x=1.7g
过氧化氢溶液中溶质的质量分数是1.7g÷34g×100%=5%
答:略


科目:初中化学 来源: 题型:
【题目】下列图像能正确反映对应变化关系的是

A. 加热一定量高锰酸钾
B. 将水通电电解一段时间
C. 向一定量的二氧化锰中加入过氧化氢溶液
D. 向两份完全相同的稀盐酸中分别加入锌粉和镁粉
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】与水相关的叙述正确的是
A. 电解水的化学方程式是H2O![]() H2↑+O2↑
H2↑+O2↑
B. 电解水产生的氧气和氢气的质量比为2:1
C. 自来水生产中用氯气杀菌消毒
D. 为防止水污染应禁止使用农药
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定条件下,甲、乙反应生成丙的微观示意图如下,下列说法错误的是

A. 反应前后分子数不变
B. 甲是化合物、乙是单质
C. 一个X分子中有三个原子
D. 参加反应的甲、乙的物质的量之比为2:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钠和硝酸钾的溶解度曲线如图所示,请回答:
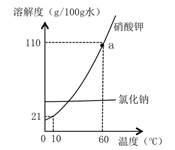
①图中a点的含义是______,60℃时,两物质中溶解度较大的是______;
②当硝酸钾中含有少量氯化钠时,可采用_______的方法提纯硝酸钾;
③将氯化钠的饱和溶液转化为同温下的不饱和溶液,可采用的方法是_______;
④如图所示,10℃时向硝酸钾溶液(底部有Xg硝酸钾晶体)中加入10g水并充分搅拌,恢复至10℃,正确的说法是______。

A.所得溶液一定饱和
B.溶质质量一定变大
C.溶质质量分数可能变大
D.若X< 2.1g,所得溶液不饱和
⑤工业上用电解饱和食盐水的方法制取氢氧化钠。反应原理是:
2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH。
H2↑+Cl2↑+2NaOH。
Ⅰ.该实验中正极产生的气体呈黄绿色,具有剌激性气味,该气体是_____(填“H2”或“Cl2”)。向电解后的溶液中滴加硫酸铜溶液,可观察到_____,证明反应生成了氢氧化钠。
Ⅱ.电解食盐水时,若有0.5molNaCl参加反应,生成氢氧化钠的质量是_______g。(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了酸和碱的化学性质后,同学们围绕“酸和碱的中和反应”开展了探究活动。请你参与学习并填写空格。
李军同学将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中,一会儿后,发现忘记了滴加指示剂。于是他从烧杯中取出少量反应后的溶液于试管中,滴入几滴酚酞溶液,振荡,观察到无明显现象。此中和反应的化学方程式为______________________。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质组成是什么?
【假设猜想】针对疑问,大家纷纷提出猜想
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和_________
同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的是猜想______。
【实验探究】为了验证其余猜想,同学们利用烧杯中的溶液,进行如下方案的探究。
实验方案 | 实验现象 | 结论与解释 |
方案一:滴加Na2CO3溶液 | __________________ | 溶液中有H2SO4 |
方案二:滴加BaCl2溶液 | ____________ | 溶液中有H2SO4 |
【得出结论】通过探究,同学们一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究给予了肯定,同时指出实验方案中有一个是错误的,错误的原因是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com