
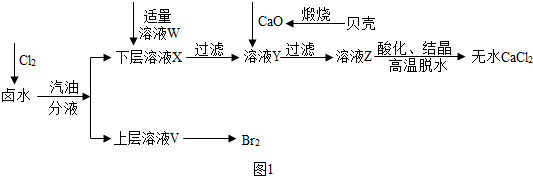

分析 (1)根据反应的原理以及化学方程式的写法来分析;
(2)根据反应要求需要除去硫酸根离子;
(3)检验沉淀最后一次洗涤的溶液中是否存在其他离子;
(4)根据化学反应中元素的质量保持不变以及化学方程式的相关计算来分析;
(5)根据酸化的目的来分析;
(6)CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必需插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来.
解答 解:(1)氯气与溴化镁溶液反应生成氯化镁和溴;故填:Cl2+MgBr2=MgCl2+Br2;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去;故填:除去混合溶液中的硫酸根离子;
(3)将沉淀最后一次洗涤的溶液中加入碳酸钠溶液,观察是否有沉淀产生;故填:将沉淀最后一次洗涤的溶液中加入碳酸钠溶液,观察是否有沉淀产生,若无明显现象,则证明沉淀已经清洗干净;
(4)解:设生成1.6gBr2的同时生成氯化镁的质量为x,则
Cl2+MgBr2=MgCl2+Br2
95 160
x 1.6g
$\frac{95}{160}$=$\frac{x}{1.6g}$
x=0.95g
设与氢氧化钙反应需要氯化镁的质量为y
CaO+H2O=Ca(OH)2,Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
CaO~MgCl2
56 95
1.12g y
$\frac{56}{95}=\frac{1.12g}{y}$
y=1.9g
则硫酸镁与氯化钡反应生成氯化镁的质量为:1.9g-0.95g=0.95g
设生成0.95g氯化镁需要硫酸镁的质量为z,则
MgSO4+BaCl2=BaSO4↓+MgCl2
120 95
z 0.95g
$\frac{120}{95}=\frac{z}{0.95g}$
z=1.2g
MgSO4在100g卤水中的质量分数为$\frac{1.2g}{100g}×100%$=1.2%.故填:1.2%;
(5)溶液z中含有氯化钙和氢氧化钙,加入适量的稀盐酸将氢氧化钙转化为氯化钙,故填:盐酸;
(6)实验室制取CO2的特点是固体和液体反应且不需要加热,由于盐酸易挥发,因此在收集之前需要出去挥发出HCl气体,因为CO2的密度大于空气中的,所以采用向上排空气发收集CO2气体.若采用长颈漏斗时,长颈漏斗的下端必须插入到溶液中,以防止CO2气体从长颈漏斗中挥发出来,因此选项b正确,故答案为:b.
点评 本题主要考查常见的基本实验操作、仪器的使用、离子的除杂和实验方案设计,综合性强,平时注意相关知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液 | 只有白色沉淀产生 | 猜想(B)正确 |
| 先有气泡产生,后有白色沉淀产生 | 猜想(C)正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生活污水直接排入大海 | B. | 农业灌溉改漫灌为滴灌 | ||
| C. | 用淘米水浇花 | D. | 工业废水经净化处理再排放 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com