
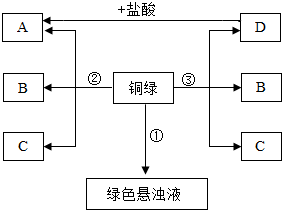
 小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一墨绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜(俗称铜绿)[Cu2(OH)2CO3],于是他和几个同学按如下方案进行了实验.
小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一墨绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜(俗称铜绿)[Cu2(OH)2CO3],于是他和几个同学按如下方案进行了实验.分析 根据碱式碳酸铜受热分解能生成氧化铜、水和二氧化碳,和盐酸反应能生成氯化铜、水和二氧化碳;氧化铜和盐酸反应能生成氯化铜和水;氯化铜和氢氧化钠反应能生成氢氧化铜沉淀和氯化钠;氢氧化铜受热分解能生成氧化铜和水进行分析;根据反应物和生成物及其质量守恒定律可以书写化学方程式.
解答 解:(1)碱式碳酸铜受热分解能生成氧化铜、水和二氧化碳,和盐酸反应能生成氯化铜、水和二氧化碳;氧化铜和盐酸反应能生成氯化铜和水;所以A是氯化铜,D是氧化铜,C是二氧化碳,B是水;故填:CuO;CuCl2;
(2)实验③反应碱式碳酸铜分解产生氧化铜、水和二氧化碳;故填:Cu2(OH)2CO3 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O;
(3)蓝色絮状沉淀是氯化铜和氢氧化钠反应产生的氢氧化铜沉淀,氢氧化铜受热分解能生成氧化铜和水,反应的化学方程式为:Cu(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
故反应的方程式分别为:CuCl2+2NaOH═Cu(OH)2↓+2NaCl;Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$ CuO+H2O;
(4)根据分析可知氧化铜受热不能分解,铜绿加热能够分解,氢氧化铜沉淀稍加热就能分解,说明热稳定性最差;故填:D>铜绿>氢氧化铜 (或氧化铜>铜绿>氢氧化铜).
点评 解答本题要掌握化学方程式的书写方法和各种物质的性质等方面的知识,只有这样才能对相关方面的问题做出正确的判断.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 铝表面的氧化铝薄膜起保护作用,则铁表面的氧化铁也起保护作用 | |
| B. | 点燃氢气前须要检验其纯度,则点燃甲烷前也须要检验其纯度 | |
| C. | 盐是由金属离子和酸根离子构成的化合物,所以盐中一定含有金属离子 | |
| D. | 复分解反应中有沉淀、气体或水生成,所以有上述物质生成的反应就是复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加热时间 (小时) | 焦谷氨酸钠含量(%) | ||
| 100℃ | 107℃ | 115℃ | |
| 0.5 | 0.3 | 0.4 | 0.7 |
| 1.0 | 0.6 | 0.9 | 1.4 |
| 2.0 | 1.1 | 1.9 | 2.8 |
| 4.0 | 2.1 | 3.6 | 5.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com