23、探究是一种重要的学习方式,是充分理解学科本质的基本途径.请你和化学兴趣小组的同学一起完成下面三个探究实验.
实验一:实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO
2反应而变质.兴趣小组的同学对一瓶久置的“碱石灰”作了如下探究:
(1) 猜想
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO
3和Na
2CO
3.
(2) 实验
如图所示:

(3) 判断
a.若Ca(OH)
2、CaCO
3和Na
2CO
3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
不成立
(填:成立、不成立).
b.操作④发生化学反应的方程式为
CaCO3+2HCl═CaCl2+CO2↑+H2O
;由操作⑤⑥的现象判断:滤液中含有
Na2CO3
(写化学式);由此判断猜想Ⅰ
不成立
(填:成立、不成立).
c.综合a和b的结论,判断该样品变质情况为
部分变质
.
(4) 拓展
由上述实验说明,实验室中“碱石灰”应
密封
保存.
实验二:向NaOH溶液中滴入紫色石蕊试液,溶液显蓝色.
(1)提出问题:是什么粒子使紫色石蕊试液变蓝色呢?
(2)查找资料:NaOH溶液中存在的粒子有大量的H
2O、Na
+、OH
-和极少量的H
+.
(3)猜想:是大量的OH
-使紫色石蕊试液变蓝色.
(4)实验探究步骤及其说明:
①在一支干净试管中加入2mL蒸馏水,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明
H2O不能使石蕊试液变蓝色
;
②在一支干净试管中加入2mL氯化钠溶液,再滴入几滴紫色石蕊试液,溶液几乎不变色,说明
Na+不能使紫色石蕊试液变蓝色
;
③在一支干净试管中加入2mL
氢氧化钠
溶液,再滴入几滴紫色石蕊试液,溶液变蓝色,说明OH
-能使紫色石蕊试液变蓝色.
(5)结论:原假设
成立
.(填“成立”或“不成立”)
实验三:实验室的废液中,可能含有氯化铁、硫酸、氯化钠、碳酸钠和硝酸钡中的一种或多种.化学兴趣小组的同学对废液进行了如下试验:
(1)取废液观察,为无色溶液;
(2)取废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;
(3)另取废液,向其中加入铁粉后,产生大量气泡.
根据以上试验现象可推断,废液中肯定含有
硫酸
,肯定不含有
氯化铁、碳酸钠、硝酸钡
.
通过实验还不能确定是否含有的物质是
氯化钠
.为了确定它是否存在,同学们设计了下面的实验方案,请按同学们的思路填写表:




 春雨教育同步作文系列答案
春雨教育同步作文系列答案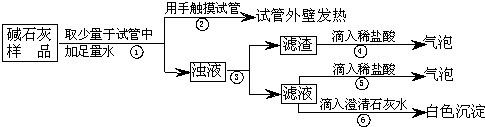



![]() 充分煅烧后CaCO3 CaO+CO2↑,将剩余固体投入水中,固体全部溶解,则生成
充分煅烧后CaCO3 CaO+CO2↑,将剩余固体投入水中,固体全部溶解,则生成