
| A. | OH-和Fe3+ | B. | H+和OH- | C. | Fe3+和K+ | D. | H+和Fe3+ |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:推断题
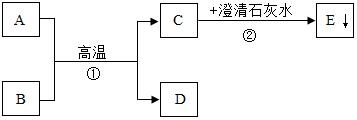 已知A、B为两种黑色粉末,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.
已知A、B为两种黑色粉末,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
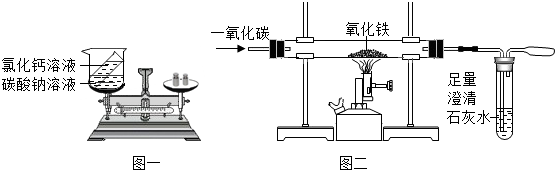
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2可用于光合作用、灭火、人工降雨等 | |
| B. | CO能燃烧,具有毒性和还原性 | |
| C. | CO和CO2性质和用途的差异较大,是因为组成它们的元素的种类不同 | |
| D. | CO2不供给呼吸的性质和CO的毒性都会致人死亡 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
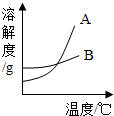 运用溶解度表与溶解度曲线图回答下列问题:
运用溶解度表与溶解度曲线图回答下列问题:| 温度/°C | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
| 碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )
在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )| A | B | C | D | |
| 甲 | Zn | H2SO4 | CO | O2 |
| 乙 | HCl | NaOH | O2 | C |
| 丙 | CuO | CuSO4 | Fe2O3 | CO |
| 丁 | Cu | Mg | C | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 已知某元素的原子结构示意图如图,该原子的质子数是19,该元素属于金属元素(填金属元素或非金属元素),在化学变化中容易失去一个电子,成为钾离子.
已知某元素的原子结构示意图如图,该原子的质子数是19,该元素属于金属元素(填金属元素或非金属元素),在化学变化中容易失去一个电子,成为钾离子.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
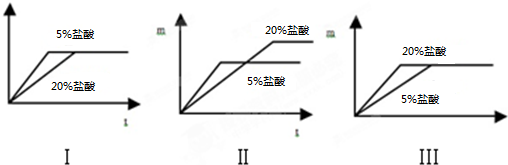
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com