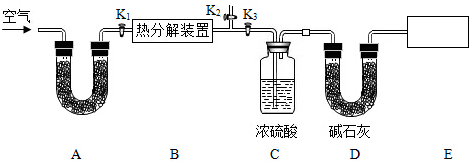
解答:解:(1)【提出问题】由于该粉末是铜粉和和氧化铁粉中的一种或两种.由粉末可能为:①只有氧化铁,②只有铜,③氧化铁的铜的混合物;故答案为:氧化铁和铜的混合物;
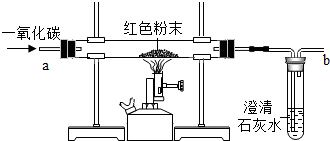
(2)取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后加热至充分反应.
A、由于结论是:“假设1成立”,说明红色固体是铜,铜不和一氧化碳反应;故答案为:无现象;
B、由于结论是:“假设2成立”,说明红色固体是氧化铁,氧化铁和一氧化碳在高温条件下会生成黑色的铁粉;故答案为:红色粉末全部变黑;
C、由于结论是:“假设3成立”,说明红色固体是氧化铁和铜的混合物,氧化铁和一氧化碳在高温条件下会生成黑色的铁粉,而铜不和一氧化碳反应;故答案为:红色粉末部分变黑;
(4)由于(3)中确认:“假设3成立”,说明红色粉末是氧化铁和铜的混合物;
①氧化铁和一氧化碳在高温条件下会生成黑色的铁粉和二氧化碳,其反应的化学方程式为:3CO+Fe
2O
32Fe+3CO
2;而铜不和一氧化碳反应;故答案为:3CO+Fe
2O
32Fe+3CO
2;
②实验时要先通入一氧化碳片刻后再加热,否则混有空气的一氧化碳点燃可能引起爆炸;故答案为:防止混有空气的CO引起爆炸;
③由于实验过程中会有一部分一氧化碳气体没有发生反应,而一氧化碳是空气污染物之一,故要在装置后面加一尾气处理装置;故答案为:加尾气处理装置;
(5)【拓展】由于在金属活动性里,铁在氢的前面,氢在铜的前面.
A、铁可以和硝酸铜溶液发生反应,说明铁的活动性比铜强;故A正确;
B、铁可以和稀盐酸反应生成氢气,而铜不和稀盐酸反应,说明说明铁的活动性比铜强;故B正确;
C、铁和铜都不和氯化亚铁反应,不能比较铁和铜金属活动性的强弱;故C错误;
枚答案为:AB;
(二)、(2)将此固体粉末加到水中,上层溶液为无色,说明固体物质中没有FeCl
3(FeCl
3的溶液是黄色的);得到白色沉淀,由于题目中Na
2CO
3、K
2SO
4、NaOH、BaCl
2都溶于水,说明产生的沉淀是物质反应后生成的,可能产生沉淀的反应有:碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠;硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾;其中碳酸钡能溶于稀硝酸且产生二氧化碳气体而硫酸钡不溶于稀硝酸;由于“该白色沉淀部分溶于稀HNO
3,且有气体放出”说明沉淀中既有碳酸钡又有硫酸钡,说明原固体粉末中有:氯化钡、硫酸钾、和碳酸钠;由于氢氧化钠的存在不影响上面的现象,故氢氧化钠可能存在.
故答案为:Na
2CO
3、K
2SO
4、BaCl
2 FeCl
3;
(3)由上面(二)、(2)的分析可知:可能存在的物质是氢氧化钠,由于碳酸钠溶液呈碱性,所以要想证明氢氧化钠的存在,可先加入足量的氯化钙溶液除去溶液中的碳酸钠(氯化钙溶液呈中性),其反应的化学方程式为:CaCl
2+Na
2CO
3═CaCO
3↓+2NaCl;再证明溶液呈碱性即可.
故答案为:取一支试管,加入上层无色溶液少许,逐滴滴加氯化钙溶液,到不再产生沉淀为止;滴加无色酚酞试液 溶液变红 CaCl
2+Na
2CO
3═CaCO
3↓+2NaCl.

 (一)在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
(一)在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.

 名校课堂系列答案
名校课堂系列答案