
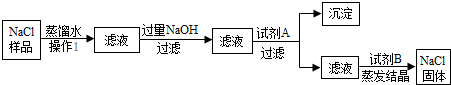
分析 过滤能将固体和液体分析,要除去食盐样品中沙土、氯化钙和氯化镁,应先过滤除去沙土,再加入过量的氢氧化钠除去氯化镁,加入过量的碳酸钠除去氯化钙,再通过过滤除去氢氧化镁和碳酸钙沉淀,由于得到的滤液中含有过量的氢氧化钠和碳酸钠,应加入适量的稀盐酸,最后通过蒸发氯化钠固体.据此分析回答有关的问题.
解答 解:(1)沙土不溶于水,可以通过过滤,将沙土与液体分离开,加入试剂氢氧化钠是为了除去氯化镁,因为氢氧化镁是沉淀,加入试剂A是为了除去氯化钙,由于碳酸钙是沉淀,又不能引入新的杂质,所以加入碳酸钠溶液就行,碳酸钠与氯化钙反应生成碳酸钙沉淀;
(2)由粗盐提纯的流程可知,前面加入了过量的氢氧化钠和碳酸钠会混入溶液中,所以加入试剂B是稀盐酸,目的是除去过量的氢氧化钠和碳酸钠.
(3)蒸发结晶时用到玻璃棒的作用是搅拌,防止局部温度过高,造成液体飞溅.
故答为:(1)过滤,碳酸钠,碳酸钙;(2)稀盐酸 除去过量的氢氧化钠和碳酸钠;(3)搅拌,防止局部温度过高,造成液体飞溅.
点评 除杂质时加入的试剂只能与杂质反应,不能引入新的杂质,将不溶于液体的固体和液体分离用过滤的方法.


科目:初中化学 来源: 题型:多选题
| A. | 二甲醚中C、O元素质量比3:2 | B. | 一个二甲醚分子中含有3个氢分子 | ||
| C. | 二甲醚相对分子质量为46 | D. | 二甲醚属于有机化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 | |
| 取样,加一定量水充分溶解后,过滤 | 取少量滤渣于试管中,加入足量稀盐酸(或HCl) | 有气泡产生 | 该石灰浆部分变质 |
| 取少量滤液于试管中,滴入无色酚酞试液 | 溶液变红 | ||
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 化学兴趣小组的同学对如图的某膨化食品包装袋内气体的成分进行探究,请你参与他们的探究,并回答下列问题.
化学兴趣小组的同学对如图的某膨化食品包装袋内气体的成分进行探究,请你参与他们的探究,并回答下列问题.| 实验步骤 | 实验现象 | 实验结论 |
| 向其中一瓶气体中滴加澄清石灰水,振荡,观察现象. | 澄清石灰水变浑浊 | 猜想2不成立 |
| ①将点燃的镁条伸入另一瓶气体中燃烧. ②完全反应后取少量固体物质加入足量的蒸馏水溶解,并滴入无色酚酞溶液,振荡观察现象. | ①镁条剧烈燃烧,发出耀眼的白光. ②溶液就变红,同时有白色沉淀产生 | 猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 黄酮素属于氧化物 | B. | 黄酮素由27个原子构成 | ||
| C. | 黄酮素的相对分子质量为222 | D. | 黄酮素中碳、氧元素的质量比为3:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com