将碳酸钠和氯化钠的固体混合物15.6g放入烧杯中,加入100g水完全溶解.然后向烧杯中加入50g稀盐酸,恰好完全反应,得到161.2g溶液.请计算:
(1)产生二氧化碳多少克?
(2)所得溶液中溶质的质量分数是多少?
解:(1)由质量守恒定律可知,生成的二氧化碳的质量=15.6g+100g+50g-161.2g=4.4g;
(2)设原固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y,
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 117 44
x y 4.4g
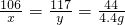
x=10.6g y=11.7g
所得溶液中溶质的质量=11.7g+(15.6g-10.6g)=16.7g
所得溶液中溶质的质量分数=
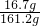
×100%=10.4%?
故答案为:(1)4.4;(2)所得溶液中溶质的质量分数10.4%.
分析:(1)根据质量守恒定律,化学反应前后物质的总质量不变,向碳酸钠和氯化钠的固体混合物中加入稀盐酸,只是碳酸钠与盐酸反应,反应后生成了二氧化碳气体不存在于溶液中,可以求得二氧化碳的质量;
(2)要求溶液中溶质的质量分数,需要知道溶质的质量,而溶质有两部分,一部分是原有的氯化钠,一部分是生成的氯化钠.
点评:本题通过计算的形式考查了碳酸盐与酸的反应,要计算生成的二氧化碳的质量,需根据质量守恒定律,本题的易错点就是在求所得溶液中溶质的质量分数时溶质的质量漏算固体中原有的氯化钠.

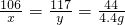
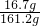 ×100%=10.4%?
×100%=10.4%?

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案