
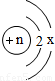 粒子进行研究,下列结论中,错误的是( )
粒子进行研究,下列结论中,错误的是( )

科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量的烧碱样品置于试管中加水溶解,用手触摸试管外壁. | 试管外壁发热 | 原因是 氢氧化钠溶于水时放出热量 氢氧化钠溶于水时放出热量 |
| ②向①所得的溶液中加入盐酸至过量. | 开始时无明显现象,过一段时间后有气泡产生. | 说明样品中含有杂质 Na2CO3 Na2CO3 |
| ③向②所得的溶液中加入硝酸银溶液. | 有白色沉淀产生. | AgNO3+NaCl═AgCl↓+NaNO3 说明样品中含有杂质氯化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:013
某化学学习兴趣小组对
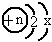 粒子进行探究,下列结论中,错误的是
粒子进行探究,下列结论中,错误的是
[
]A
.当x=6且该粒子为原子时,核电荷数n应为8B
.当x=8且该粒子为阴离子时,核电荷数n应为12C
.当n=11且该粒子为阳离子时,x应为8D
.当x=8时,粒子中n越大,原子核对电子吸引力越大,粒子体积越小查看答案和解析>>
科目:初中化学 来源: 题型:单选题
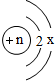 粒子进行研究,下列结论中,错误的是
粒子进行研究,下列结论中,错误的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com