(2012?泰州)硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
(1)用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色,这主要是由于浓硫酸具有
脱水
脱水
性,使纸中的纤维素炭化的缘故;在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其
吸水
吸水
性.
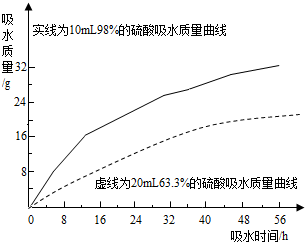
(2)探究浓硫酸的吸水性.兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,称量、观察、记录、分析.根据室温环境下实验的数据绘成的曲线如图:
①稀释浓硫酸时,应将
浓硫酸
浓硫酸
缓缓地注入盛有
水
水
的烧杯中并不断搅拌;
②由右图曲线你能得到的实验结论有哪些?(写两点)
浓硫酸和一定浓度以上的稀硫酸都具有吸水性
浓硫酸和一定浓度以上的稀硫酸都具有吸水性
、
浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大)
浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大)
.
(3)探究浓硫酸能否使铁钝化(钝化指在表面形成氧化膜保护层,使内层金属不再发生变化).可选用的实验药品有:相同铁片若干、浓硫酸、稀硫酸、硫酸铜溶液等.实验仪器任选.
①兴趣小组已经完成下表实验Ⅰ和Ⅱ,请你帮他们将实验报告补充完整.
| 方案 |
实验假设 |
实验方案 |
实验现象与结论 |
| Ⅰ |
能发生钝化 |
取一铁片先插入浓硫酸中,一段时间后取出,再插入硫酸铜溶液中. |
无明显变化,假设成立. |
| Ⅱ |
能发生钝化 |
取两片相同的铁片,一片放入浓硫酸中,一段时间后取出,与另一片同时放入硫酸铜溶液中. |
浸过浓硫酸的铁片表面无明显变化,另一铁片表面产生红色固体 浸过浓硫酸的铁片表面无明显变化,另一铁片表面产生红色固体 ,假设成立. |
你认为方案Ⅱ与方案Ⅰ相比,方案Ⅱ的优点是
采用了对比实验的方法,更科学
采用了对比实验的方法,更科学
.
②请你选用提供的药品再设计一个实验,简述实验方案:
取两片相同的铁片,一片放入浓硫酸中一段时间,取出,与另一片同时放入稀硫酸溶液中.(其它合理答案均可)
取两片相同的铁片,一片放入浓硫酸中一段时间,取出,与另一片同时放入稀硫酸溶液中.(其它合理答案均可)
.
③某同学将一铁片插入盛有98%的浓硫酸的试管中,无明显变化,再给试管加热一段时间后,发现溶液变色并有刺激性气味气体产生,此现象说明:
加热条件下,氧化膜被破坏(被浓硫酸溶解),铁继续与浓硫酸反应.(或热的浓硫酸能与铁反应产生刺激性气体;或热的浓硫酸不能使铁钝化;或铁的钝化随条件的改变而改变;或铁与浓硫酸的作用与温度有关)(其它合理答案均可)
加热条件下,氧化膜被破坏(被浓硫酸溶解),铁继续与浓硫酸反应.(或热的浓硫酸能与铁反应产生刺激性气体;或热的浓硫酸不能使铁钝化;或铁的钝化随条件的改变而改变;或铁与浓硫酸的作用与温度有关)(其它合理答案均可)
.