

| 实验操作 | 实验现象 | 实验结论 |
| 任取三种溶液于三支试管中,分别滴加第四种溶液 | ①一支试管中有气泡放出,其余两支试管中无明显变化 | ①第四种溶液为稀盐酸 |
| ②一支试管中有白色沉淀析出,其余两支试管中溶液无明显变化 | ③第四种为Na2CO3溶液 | |
| ④三支试管中溶液均无明显变化 | ②第四种为NaOH溶液 |

分析 甲组实验方案:
根据酸碱指示剂在酸碱中的显色进行分析;
根据碳酸盐和酸反应会生成二氧化碳气体进行分析;
根据碳酸根离子会与钙离子反应生成碳酸钙沉淀进行分析;
乙组实验:根据碳酸钠和其余三种物质反应的现象进行分析;
丙组实验:根据碳酸钠和氢氧化钙反应会生成碳酸钙沉淀进行分析;
丁组实验:根据稀盐酸具有挥发性,氢氧化钙的溶解度随温度的升高而降低,氢氧化钙能够和碳酸钠反应产生沉淀进行分析.
解答 解:甲组实验:
(1)石蕊遇酸显红色,所以2号就是酸性溶液,故答案为:稀盐酸;
(2)盐酸和碳酸盐反应会生成二氧化碳气体,所以3号就是碳酸钠溶液,故答案为:碳酸钠溶液;
(3)氢氧化钠和氢氧化钙中的阳离子不同,可以通过鉴别阳离子鉴别两者,碳酸钠和氢氧化钙会生成碳酸钙沉淀和氢氧化钠没有现象,故答案为:3号溶液 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
乙组实验:碳酸钠和盐酸反应会生成二氧化碳气体,和氢氧化钙反应会生成碳酸钙沉淀,和氢氧化钠反应没有明显现象,故答案为:②;一支试管中有气泡放出、一支试管中有白色沉淀析出、一支试管中无明显现象;
丙组实验:A,B,C均无明显变化,D中有沉淀析出,所以2、4就是碳酸钠和氢氧化钙,1、3就是氢氧化钠和盐酸,故答案为:NaOH、Ca(OH)2、HCl、Na2CO3或HCl、Na2CO3、NaOH、Ca(OH)2(本题只需要将1中液体滴加到D试管中就可以确定是可能中的哪一种,若沉淀溶解就是后一顺序,沉淀不溶解就是前一顺序);
丁组实验:将四种溶液重新编号为1、2、3、4,各取少量溶液于四支试管中,分别加热.1中产生刺激性气味,因此是具有挥发性的稀盐酸;2、3无明显变化,4中溶液变浑浊,可知4号是氢氧化钙,因为氢氧化钙的溶解度随温度的试管而降低,会有氢氧化钙的析出;冷却后,再取少量澄清4号溶液滴入2、3中,2号溶液无明显变化,3号溶液变浑浊,氢氧化钙和碳酸钠反应成是碳酸钙沉淀,因此3号是氢氧化钙,则2号是氢氧化钠;故答案为:稀盐酸;氢氧化钙的溶解度随温度的升高而降低,因此石灰水加热时会有氢氧化钙的析出.
点评 本题考查了常见物质的鉴别,在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答.


科目:初中化学 来源: 题型:解答题
| 实验步骤 | 现象 | 结论 |
| 1.取少量固体,往其中滴加稀盐酸. | 有气泡冒出 | 固体中含有碳酸钠 |
| 2、另取少量固体,加水充分溶解,加入过量的氢氧化钙溶液. | 产生白色沉淀 | 固体中含有碳酸钠. |
| 3、对上述反应后的混合物过滤,在滤液中加入酚酞溶液. | 变红色 | 固体中含有氢氧化钠. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
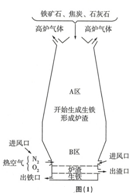 钢铁工业是国家工业的基础.
钢铁工业是国家工业的基础.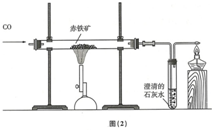
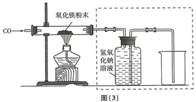
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 呼出气体中二氧化碳含量小于空气 | B. | 呼出气体中水蒸气含量大于空气 | ||
| C. | 呼出气体中二氧化碳含量大于空气 | D. | 呼出气体中水蒸汽含量小于空气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com