
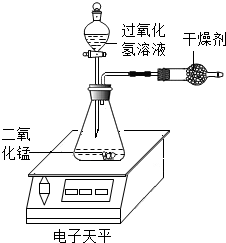
 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2O2溶液浓度 | 5% | 5% | 5% | 10% | 10% | 30% | 30% |
| MnO2粉末(g) | 1.0 | 0.8 | 0.6 | 0.6 | 0.4 | 0.4 | 0.2 |
| 所用的时间(s) | 205 | 205 | 220 | 80 | 90 | 3 | 4 |
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 示数(g) | 565.40 | 565.37 | 565.34 | 565.30 | 565.28 | 565.26 | 565.24 | 565.23 | 565.22 | 565.21 | 565.20 |
分析 [作出猜想]根据与反应有关的外界及内部条件来作出猜想,例如物质的浓度,温度等.
[实验验证]
(1)①根据化学方程式的书写方法进行分析.
②比较表格中的数据在其他条件都相同时,可以看出过氧化氢的浓度对反应速率的影响.
③比较表格中的数据在其他条件都相同时,可以看出二氧化锰的用量对反应速率的影响.
④若撤除干燥管装置,会导致氧气逸出带走部分水分,所测速率偏大.
(3)过氧化氢溶液分解速度的变化情况是逐渐变慢,原因是过氧化氢的浓度逐渐减小.
(4)在催化剂改变的时候,对反应的速率是不是有影响,可以选择其他的物质来进行实验进行验证.
解答 解:[作出猜想]根据与反应有关的外界及内部条件来作出猜想本题中所涉及的就是温度、物质的浓度和质量,故填:温度;
[实验验证]
(1)①过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②实验3和4,二氧化锰的质量相同,过氧化氢溶液的体积相同,但过氧化氢的浓度不同,收集到相同体积的氧气所用的时间不同,说明在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快,故填:3、4;在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快;
③根据表中数据可以看出,在过氧化氢溶液浓度、温度等相同的条件下,MnO2的用量越大(在一定范围内),反应越快;但是达到一定的用量时,速率不在改变,故填:二氧化锰的用量越多,反应速率越快,达到一定的用量时,速率不在改变;
④若撤除干燥管装置,会导致氧气逸出带走部分水分,所测速率偏大,故填:偏大.
在过氧化氢浓度相等和二氧化锰用量相等的条件下,来比较在不同的温度下的反应快慢.故填:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
(3)上表数据分析得出,过氧化氢溶液分解速度的变化情况是逐渐变慢,原因是过氧化氢的浓度逐渐减小,故填:逐渐变慢;过氧化氢的浓度逐渐减小.
(4)还想探究的是在催化剂改变的时候,对反应的速率是不是有影响,可以选择其他的物质来进行实验进行验证.故填:除MnO2外,是否还有其它物质可作此反应的催化剂.
点评 本题主要考查了能够影响化学反应的因素,解答这类题时要注意尽可能的把题中的能够影响化学反应的因素找出,然后再利用控制变量法来进行实验,最后得出答案.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaNO3、NaCl、KNO3、(NH4)2SO4 | B. | H2SO4、HCl、AgNO3、Na2SO4 | ||
| C. | KMnO4、CuCl2、Fe2(SO4)3、NaNO3 | D. | K2SO4、NaCl、K2CO3、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
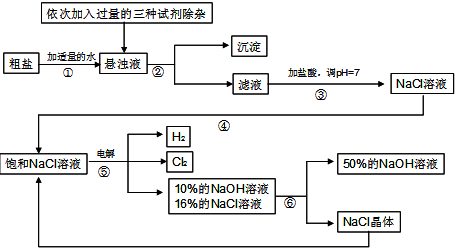
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
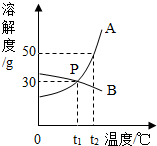 如图是A、B两种物质的溶解度曲线.
如图是A、B两种物质的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com