
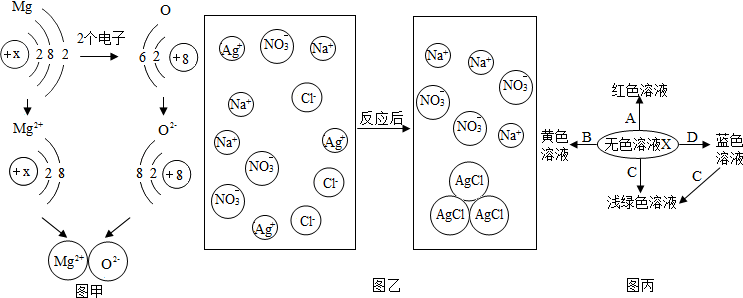
分析 (1)①根据氧元素在形成化合物时通常显-2价,镁元素通常显示+2价,原子得失电子后,质子数不变进行分析;
②根据有氧参加的反应叫氧化反应,镁原子最外层有两个电子,容易失去两个电子形成稳定结构进行分析;
③根据原子得到电子后质子数不变,电子数增加,所以形成的离子带负电,化合价降低进行分析;
(2)①根据常见离子的名称进行分析;
②根据复分解反应的实质进行分析;
③根据常见化学方程式的书写规则进行分析.
(3)根据图框的信息及所学知识,可知黄色溶液应该是铁盐的溶液,浅绿色的溶液应该是亚铁盐的溶液,蓝色溶液应该是铜盐的溶液,那么无色溶液就应该是酸的溶液,从而可以得出,紫色石蕊遇酸变红色,故A为紫色石蕊,B为氧化铁,C为铁,D为氢氧化铜,同时蓝色溶液可以与C反应生成浅绿色溶液,也可以验证C为铁,据此可以完成该题的解答.
解答 解:(1)①氧元素在形成化合物时通常显-2价,镁元素通常显示+2价,所以氧化镁的化学式为MgO,原子得失电子后,质子数不变,所以图中的x=12;
②有氧参加的反应叫氧化反应,所以镁与氧气的反应属于氧化反应,镁原子最外层有两个电子,容易失去两个电子形成稳定结构;
③原子得到电子后质子数不变,电子数增加,所以形成的离子带负电,化合价降低;
(2)①图中NO3-的名称是硝酸根离子;
②通过分析微观图可知,该反应的实质是氯离子和银离子结合生成沉淀;
③盐酸和硝酸银反应生成氯化银沉淀和硝酸,化学方程式为:HCl+AgNO3=AgCl↓+HNO3.
(3)①由题意可知,黄色溶液、蓝色溶液、浅绿色溶液都是盐的溶液,能够三种物质反应生成可溶性的且带颜色的盐的只有酸的溶液,所以X应该为酸,和酸反应生成红色溶液的就是紫色石蕊试液;
②若X为稀硫酸,B为氧化物,它们生成的是黄色溶液,我们知道的黄色溶液应该为铁盐的溶液,所以B应该为氧化铁,化学式为:Fe2O3
③我们所学的浅绿色的溶液只有亚铁盐的溶液,当X为稀盐酸,C为单质时,那么可以知道C应该为单质铁.
④我们所学的蓝色溶液只有铜盐的溶液,所以在这里和稀硫酸反应的碱应该为氢氧化铜,反应的化学方程式是:H2SO4+Cu(OH)2═CuSO4+2H2O.
故答案为:(1)MgO,12;②氧化,失去;③降低;
(2)①硝酸根离子;②氯离子和银离子;③HCl+AgNO3=AgCl↓+HNO3.
(3)①酸,紫色石蕊试液;②Fe2O3;③铁;④H2SO4+Cu(OH)2═CuSO4+2H2O.
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
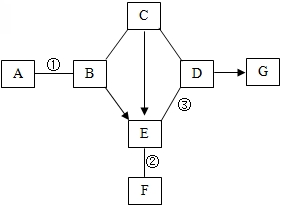 如图是初中化学中常见物质间的转化关系.其中,常温下A、B是黑色固体,B中两种元素的质量比是4:1;C的浓溶液可用作干燥剂;G俗称纯碱;反应②和③各能生成一种沉淀,且沉淀颜色不同.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
如图是初中化学中常见物质间的转化关系.其中,常温下A、B是黑色固体,B中两种元素的质量比是4:1;C的浓溶液可用作干燥剂;G俗称纯碱;反应②和③各能生成一种沉淀,且沉淀颜色不同.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
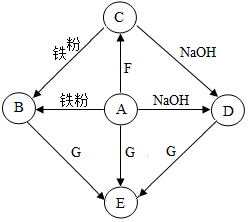 A-G是初中化学常见物质.其中,A的浓溶液能挥发出刺激性气味的气体,D是厨房中常见的调味品,E为白色沉淀,从C→D的反应过程中有蓝色沉淀生成.下图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.
A-G是初中化学常见物质.其中,A的浓溶液能挥发出刺激性气味的气体,D是厨房中常见的调味品,E为白色沉淀,从C→D的反应过程中有蓝色沉淀生成.下图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 按质量计算,空气中含有氮气约78%,氧气约21% | |
| B. | 食盐水、蔗糖水都能导电 | |
| C. | 自来水厂的净水过程有:沉淀、过滤、吸附、消毒和煮沸 | |
| D. | 电解水的实验中,正负极产生的气体体积比为1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 加碘食盐是指在氯化钠(NaCl)中加入适量的碘酸钾(KIO3).根据如图的溶解度曲线,判断下列说法中错误的是( )
加碘食盐是指在氯化钠(NaCl)中加入适量的碘酸钾(KIO3).根据如图的溶解度曲线,判断下列说法中错误的是( )| A. | 20℃时,NaCl的溶解度>KIO3的溶解度 | |
| B. | 20℃时,不可能制得相同质量分数的KIO3溶液和NaCl溶液 | |
| C. | KIO3的溶解度随温度升高而增大 | |
| D. | 20℃时,NaCl饱和溶液质量分数>KIO3饱和溶液质量分数 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com