
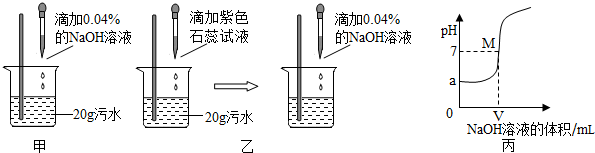
分析 (1)根据PH值的正确测定方法来考虑,否则测得的结果会产生误差;根据pH和溶液酸碱性的关系分析;
(2)根据酚酞试液在碱性溶液为红色分析结论的正确性;
(3)根据紫色石蕊试液在酸性、碱性、中性溶液中的颜色分析反应的程度并通过化学方程式进行计算;
(4)根据实验的注意事项分析玻璃棒的作用;
(5)根据坐标分析;
(6)根据酸的性质及可操作性、经济性等分析;
解答 解:
(1)测PH值的正确测定方法是:取pH试纸放在玻璃片上,用玻璃棒蘸取待测溶液沾在pH试纸上,将试纸显示的颜色与标准比色卡比较,即可得到PH值,所以乙同学、丙同学操作都是错误的,用蒸馏水将pH试纸润湿再测该酸性溶液PH值,结果会偏大;将pH试纸直接浸入溶液中会污染试剂;测得废水的pH<7,说明显酸性;
(2)根据取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞变红色,说明此时的溶液显碱性,是因为氢氧化钠溶液过量;
(3)硫酸和氢氧化钠反应生成硫酸钠和水,石蕊试液在酸性废水中出现红色,当滴加氢氧化钠的过程中,当溶液由红色变成紫色时恰好完全反应;
设污水中H2SO4的质量分数为x,
H2SO4+2NaOH═Na2SO4+2H2O
98 80
20gx 4g×0.04%
$\frac{98}{20gx}=\frac{80}{4g×0.04%}$
x=0.0098%
所以污水中H2SO4的质量分数为0.0098%;
(4)为了防止氢氧化钠过量,使反应充分进行,实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且要用玻璃棒不断搅拌;
(5)从曲线上可知污水的pH=a,即曲线的起点;M点的pH=7,溶液呈现中性,说明酸碱恰好完全反应;稀硫酸和氢氧化钠反应生成硫酸钠和水
(6)A.NaOH;B.Ca(OH)2;C.CuO;D.Fe四种物质都能够和盐酸发生反应,但从经济的角度考虑,氢氧化钙最便宜,所以性质B.;
故答案为:
(1)甲;
(2)氢氧化钠溶液过量使酚酞试液变成红色;
(3)溶液由红色变成紫色;0.0098;
(4)防止氢氧化钠过量,使反应充分进行;
(5)a;恰好完全反应;硫酸钠;
(6)B.
点评 本题考查了酸碱度的测定方法的评价,酸碱性与pH的关系以及酸碱中和反应的运用等,综合性较强,但难度不大,关键还是熟练掌握溶液酸碱性、酸碱度测定的方法及酸碱中和反应的原理.


科目:初中化学 来源: 题型:选择题
| A. | 都能加快化学反应的速度 | |
| B. | 用氯酸钾制氧气时,加入二氧化锰能增加生成物氧气的质量 | |
| C. | 在化学反应前后质量不改变 | |
| D. | 在化学反应前后性质不改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na+、Mg2+、NO3-、Fe2+ | B. | OH-、NH4+、Br-、Cl- | ||
| C. | K+、CO32-、H+、SO42- | D. | Na+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 为防治空气污染,应加强工业废气的处理 | |
| B. | 为节约化石燃料,应开发和使用新能源 | |
| C. | 为节约用水,应用工业废水直接浇灌农田 | |
| D. | 为防止铁制品生锈,应在其表面覆盖保护层 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | PH=0的溶液显中性,不能使酚酞变色 | |
| B. | 正常雨水的PH为7,酸雨的PH<7 | |
| C. | CO2气体中有水蒸气,可以用氢氧化钠溶液干燥 | |
| D. | 工业废气中的二氧化硫,可以用石水浆吸收处理,防止空气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com