
分析 根据12g的碳和32g的氧气恰好完全反应,生成二氧化碳44g,分析出6g碳在18g氧气中燃烧是谁过量,然后碳和氧气反应的量之间的关系找出比例式进行解答.
解答 解:从12g的碳和32g的氧气恰好完全反应,生成二氧化碳44g中可以看出,6g碳在18g氧气中燃烧是氧气过量,在计算时要按照碳的质量计算,
设会生成二氧化碳的质量为x,消耗氧气的质量为y,
C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2
12 32 44
6g y x
$\frac{12}{6g}$=$\frac{32}{y}$=$\frac{44}{x}$
x=22g
y=16g
所以剩余氧气的质量=18g-16g=2g.
故答案为:22,氧气,2.
点评 在解此类题时,首先根据题中所给的数据判断谁过量或不足,然后再依据方程式中的比例关系进行解答.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:解答题
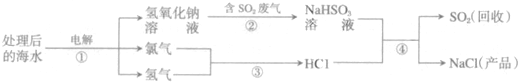
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2000余种 | B. | 1000余种 | C. | 300余种 | D. | 100余种 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 槙树造林,增加绿化 | B. | 发展公共交通,少开私家车 | ||
| C. | 大量使用煤进行火力发电 | D. | 使用一次性塑料袋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com