
����Ŀ��ij��ѧ��ȤС���ͬѧ�������ȼ�պͿ��������������IJⶨ������һϵ�е�̽����������벢�ش��������⣮ 
��1������������1����ȼ�������������������̶Ȳ�һ������ʲôԭ�������أ�
�����������1������٣������п�ȼ��ɷֲ�һ����
����ڣ� ��
��2������������2��ͬѧ�������������ײⶨ�����������ĺ�������������Ϩ�����������ƿ�е�ˮԶС��ƿ�ݻ��� ![]() ����ʲôԭ�������أ�
����ʲôԭ�������أ�
�����������2������٣�����ȼ�ղ���CO2���壻
����ڣ���
����ۣ� ��
��3����ʵ����֤���������ȼ�������������������ⶨƿ�е�����������������ͼ1��
���ó����ۡ���ʵ���п����������������������%��
��4������չ̽����
a.ijͬѧ�����������������ⶨ�ܱ���������������ȼ��ʱ�����ĺ����仯����ͼ2����110��ʱ�����ĺ������������������������½�������ά����8.85%���ң��������Ž���ͼ��仯�Ŀ���ԭ���ǣ�
����
�� ��
���������������ά����8.85%��������ô����ģ� ��
b.ͼ3��ʾװ�ÿ����ڲⶨ�����������ĺ����������뼯��ƿ������ѹǿ�������ȵ����豸�ܽ�����ƿ������ѹǿ��ȷ�ؼ�¼������������ͼ4��ͼ5���ø�װ�ò�õĺ���ľ̿�ֱ��ڼ���ƿ��ȼ�յ�ѹǿ��ʱ���ϵͼ����װ�������Ժã�p0�Ǽ���ƿ�ڳ�ʼ��ѹ��p��p��ֱ��Ƿ�Ӧ������ָ�������ʱ����ƿ�ڵ���ѹ��
�ٷ�Ӧ��ʼʱ����ƿ��ѹǿ˲�����ԭ���ǣ� ��
��p=0.79p0 �� p��=p0 �� �������һ�����ԭ�� ��
���𰸡�
��1�������������߳��̲�ͬ
��2��װ��©����û����ȴ������
��3��5.18
��4������ȼ�շų�����ʹ������������ͣ�װ��©������������װ�ã���װ�õ����������͵�8.85%ʱ�����Ͳ��ܼ���ȼ�ն�Ϩ�����������ĺ�������ά����8.85%���ң�ȼ�շ��ȣ�ѹǿ������ȼ������������ѹǿ��С������̼��������Ӧ���ɶ�����̼����Ȼ���������������������������壬װ��������ѹǿ���ֲ���
���������⣺�����������1�������������������ߵij����йأ�����Խ����������ĽӴ���Խ��ȼ��ҲԽ��ʢ����������������߳��̲�ͬ�������������2������Ϩ������ˮ�����ԶС��ƿ���ݻ������֮һ������������ȼ�������˶�����̼����������װ��©����û����ȴ�����£�����ȼ����Ҫһ�������������װ��©����û����ȴ�����£����ó����ۡ���Ӧǰ��װ���ڿ������������������ԼΪ21%������Ϩ���ƿ�������ĺ���Ϊ15.82%����ʵ���п���������������������ˣ�21%��15.82%=5.18%�����5.18������չ̽������1����110��ʱ�����ĺ������������������������½��������Ǻ���ȼ�շų�����ʹ������������ͻ�װ��©������������װ�ã��������ȼ�շų�����ʹ������������ͣ�װ��©������������װ�ã���װ�õ����������͵�8.85%ʱ�����Ͳ��ܼ���ȼ�ն�Ϩ�����������ĺ�������ά����8.85%���ң���2���ٷ�Ӧ��ʼʱ������ȼ�շų��������ȣ���������������ͣ����Լ���ƿ��ѹǿ˲���������ȼ�շ�����ɵģ��ں���ȼ������������ѹǿ��С������̼��������Ӧ���ɶ�����̼����Ȼ���������������������������壬װ��������ѹǿ���ֲ��䣮�𰸣������������1�������������߳��̲�ͬ�������������2����װ��©������û����ȴ�����£����ó����ۡ�5.18������չ�о�����1������ȼ�շų�����ʹ������������ͣ�װ��©������������װ�ã���װ�õ����������͵�8.85%ʱ�����Ͳ��ܼ���ȼ�ն�Ϩ�����������ĺ�������ά����8.85%���ң���2����ȼ�շ��ȣ�ѹǿ���ں���ȼ������������ѹǿ��С������̼��������Ӧ���ɶ�����̼����Ȼ���������������������������壬װ��������ѹǿ���ֲ��䣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦָ�����API�����в����������Ⱦָ������Ŀ�ǣ� ��
A.������̼
B.һ����̼
C.��������
D.���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ձ��в����������������壨 ��
A.��������
B.������̼
C.��������
D.һ����̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�����������ȷ���ǣ� ��
A.ˮ��������Ӻ������ӹ���
B.ˮ����������������ɵ�
C.ˮ��������һ������Ӻ�һ����ԭ�ӹ���
D.ˮ������Ԫ�غ���Ԫ����ɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������еı仯�У���֤�����ӿɷֵ���ʵ�ǣ� ��
A.ˮ���Ⱥ���ˮ����
B.��ˮͨ������õ���ˮ
C.ˮͨ��ֽ�
D.����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���йط������ʵ�ʵ�飺����ֽ����ÿ��2���״���һ����ɫ��̪��Һ������ֽ�������Թ��У������Թܿ�����һ�������õι���ȡŨ��ˮ�������������ϣ� 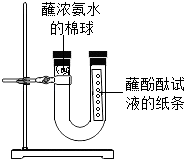
��1�����Թ۲쵽��������������˵������������֪ʶ�ش�
��2����ٳ���������˵�����Ӿ�����һ���ʵ�һ��ʵ������
��3��ijѧ������ʵ��ʱ��������ֽ��û�б�ɫ�����Թ�����������ȴ����˺�ɫ������������������Ĵ������������ �� ��һʵ�黹˵���������Լ������лӷ��ԣ�
��4��ʵ���У��������Թ������һ�Ű�ֽ����ֽ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ�����ʾ��
5����ԭ�� �� 4������������ �� 2�������� �� �����������Ļ��ϼ�Ϊ+3�� �� �������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У���ȷ���ǣ� ��
A.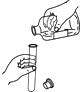
�㵹Һ��
B.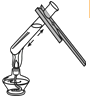
��Һ�����
C.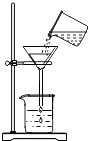
���˻��ǵ�ˮ
D.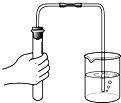
���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ��ù���������Һ�Ͷ����������������ش��������⣺
��1��Ϊ��̽���¶ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�죬������ͼ��ʾʵ��װ�ã��г�װ����ȥ���� 
����������ʵ�飬����ʵ��IJ�����������ʾ��
ʵ��1 | ʵ��2 | |
MnO2������ | 0.5�� | 0.5�� |
5%��H2O2��Һ��� | 40mL | ���� |
ˮԡ�¶� | 20�� | 80�� |
�ٴ˷�Ӧ�ķ��ű���ʽ��
��ʵ��2�С������������������������ʵ���У�����ͨ��һ��ʱ�����ڵ��Ķ�������ȷ�Ƚ�H2O2�ֽⷴӦ���ʵĴ�С��
��ʵ��2��ˮԡ�¶ȿ�����80��ʱ���ⶨ�ķ�Ӧ���ʻ����ʵֵƫ����ԭ�����ƿ���������������⣬�����ܵ�ԭ���� ��
��ʵ���������Ҫ��������ˮ��MnO2��ʣ�����з��������ʵ��������裨��������������ˮ��ϴMnO2����ɶ������̣�
��2��̽��ʹ������ľ����ȼ�����������Ũ�ȣ����ݻ�Ϊ300mL�ļ���ƿ��ˮ���ռ����������պð�ƿ��Ԥ�����е�100mLˮ�ž�ʱ������ƿ���������������Ϊ��д������ʽ���ɣ��� ��
ʵ���о������ʾ��O2�������������49%ʱ�Ϳ�ʹ�����ǵ�ľ����ȼ����ˣ��ô����ǵ�ľ������O2�ķ�������ɿ������ɿ�������Ϊ�ˣ��ռ�O2ʱ���ʹ��������������Ҫ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com