
| A. | 金刚石用于切割玻璃--金刚石坚硬 | |
| B. | 一氧化碳用于冶炼金属--一氧化碳具有可燃性 | |
| C. | 石墨用于制作坩埚--石墨熔点高 | |
| D. | 干冰用于人工降雨--干冰升华吸热 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:推断题
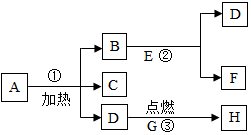 A.B…H八种物质,有图所示关系:其中A是一种暗紫色固体,B.G都是黑色固体,D能使带火星的木条复燃,E是一种无色液体,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变.试推断:
A.B…H八种物质,有图所示关系:其中A是一种暗紫色固体,B.G都是黑色固体,D能使带火星的木条复燃,E是一种无色液体,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变.试推断:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
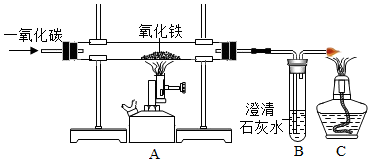
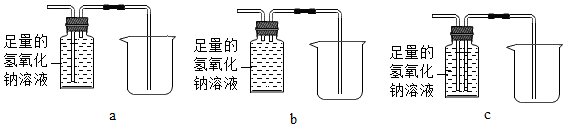
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭、红磷等物质都可以在空气中燃烧,所以空气中的氧气具有可燃性 | |
| B. | 铁在氧气中燃烧生成氧化铁 | |
| C. | 给氯酸钾加热,若不加二氧化锰就不产生氧气 | |
| D. | 课本上测定空气中氧气含量的试验中.若将红磷换成木炭实验会失败 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com