18.氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等.某兴趣小组用镁与氮气反应制备氮化镁(Mg
3N
2),并用实验方法测定氮化镁的纯度.
资料一:氮化镁是浅黄色粉末,极易与水反应生成氢氧化镁沉淀和氨气;
资料二:(NH
4)
2SO
4+2NaNO
2$\frac{\underline{\;加热\;}}{\;}$2N
2↑+Na
2SO
4+4H
2O,该反应为放热反应;
资料三:饱和硫酸亚铁溶液能吸收部分氧气;
资料四:在常温下或温度不高的条件下镁几乎与水不反应.
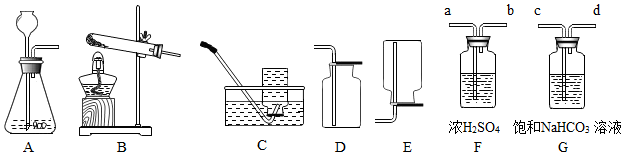
【制备氮化镁】制备氮化镁的装备示意图如下:
(1)仪器a的名称是分液漏斗,b的名称是圆底烧瓶;
(2)D装置的作用是干燥氮气,G装置的作用是防止空气中的氧气进入E装;能否将C、D装置对调否(填“能”或“否”);
(3)写出E装置中【镁与氮气反应制备氮化镁(Mg
3N
2)】发生反应的化学方程式3Mg+N
2$\frac{\underline{\;点燃\;}}{\;}$Mg
3N
2;
(4)检查整套装置气密性:用酒精灯微热烧瓶,若G处导管口有气泡产生,且冷却后G处长导管内产生稳定的水柱,则气密性良好
(5)进行实验时先进行A(选择“A”或“E”)处加热,理由是排尽空气;
(6)A处加热片刻后,应移去酒精灯,理由是该反应放出大量热.
【测定氮化镁的含量】
(7)定性测定:
步骤一、取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成;
步骤二、弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡.
①检验刺激性气味气体(氨气)的方法是将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则为氨气;
②写步骤二中产生气泡的反应(镁与盐酸)的化学方程式:Mg+2HCl═MgCl
2+H
2↑;
(8)定量测定:按下图装置进行实验.
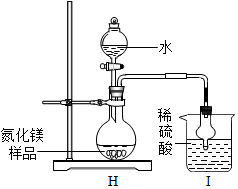
①球形干燥管的作用是充分反应,防倒吸;
②取氮化镁样品16克进行实验,I 装置增重3.4克,求该样品中氮化镁的质量分数;
已知:Mg
3N
2+6H
2O═3Mg(OH)
2+2NH
3↑
③导致该样品中氮化镁含量测定结果偏低的可能原因是产生的氨气未能全部被吸收.