
【题目】我国科学家建立国家尺度的氮足迹混合分析方法,来评价生命周期的氮流动。如图是氮元素在元素周期表的信息,下列判断不正确的是( )
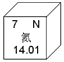
A.氮元素属于非金属元素
B.氮原子核外有2个电子层
C.氮的相对原子质量为14.01
D.化学反应中,氮原子易失去电子
 星级口算天天练系列答案
星级口算天天练系列答案科目:初中化学 来源: 题型:
【题目】(1)请根据下列实验和溶解度曲线回答问题(已知水的密度约为1 g/cm3)
实验操作 | 实验结果 |
|
取100 mL水,加入25 g硝酸钾,搅拌恢复至20℃ | 全部溶解,得溶液A | |
再加w g硝酸钾,搅拌,恢复到20℃ | 恰好饱和,得溶液B | |
再加25 g硝酸钾,搅拌,恢复到20℃ | 得溶液C | |
加热 | 全部溶解,得溶液D | |
冷却至20℃ | 析出晶体,得溶液E |
①表中w的值为__________。
②一定属于不饱和溶液的是______(填序号)。
③溶质的质量分数一定相等的溶液是B和___(填序号),此时溶质的质量分数是___(精确到0.01%)。
(2)许多果农用钼素去促进东魁杨梅优质丰产;金属元素钼(Mo)通常用作合金及不锈钢的添加剂。化工生产中制备金属钼的主要流程如下图:
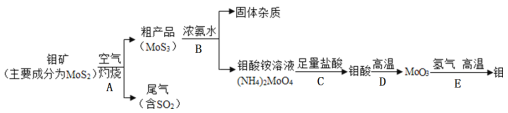
①步骤A中,灼烧钼矿通常会将矿石粉碎成小颗粒,其目的是__________________。
②现有:a烧杯b玻璃棒c漏斗d酒精灯等四种仪器,如果在实验室模拟步骤B,则不需要选用的是_____(填字母序号)。
③写出步骤E的化学方程式______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上以硫铁矿为原料生产硫酸,有关工业流程图如下:
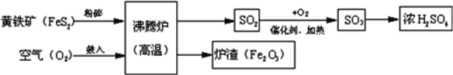
(1)硫铁矿的主要成分是FeS2,名称为二硫化亚铁,其中的硫元素化合价应为______。在加入沸腾炉之前,粉碎硫铁矿,是为了_______________________。
(2)该流程中涉及的空气污染气体是二氧化硫,形成的危害是_______。写出流程中SO2转化为SO3的化学方程式为_________________________________。
(3)实验室里将100g溶质质量分数为98%的浓硫酸稀释为10%的硫酸,需要水____g。需要的玻璃仪器有胶头滴管、玻璃棒、_______和______,此处玻璃棒的作用是_______。
(4)用稀硫酸可除去铁制品表面的铁锈,化学方程式为_____________________,硫酸在现代工业上还有哪些用途(只写一点即可)________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取气体的装置如图所示,根据所学的知识回答下列问题。
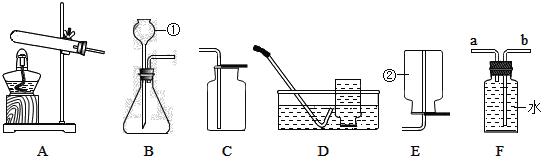
(1)图中标有①、②的仪器名称:①________;②________。
(2)写出用装置B和C制取氧气的化学方程式__________,验满的方法是_________。
(3)用C装置收集的原因是___________,若用D装置收集氧气,操作时的正确顺序为:_____→_____→_____(填编号)。
①将导管深入集气瓶口,气体进入瓶中
②将装满水的集气瓶倒置在水槽中
③当气体收集满时,用毛玻璃片盖上瓶口,将集气瓶移出水面放置
(4)B装置要通过控制滴加液体的速度,来控制反应速率,应将长颈漏斗改为_____(填仪器名称)。F装置中充满水时,可作为氧气的收集装置,则氧气应从____端通入(填“a”或“b”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应的微观过程如图,则下列说法中,不合理的是( )
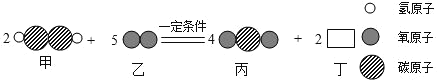
A.该反应属于置换反应B.生成物丙和丁均为氧化物
C.物质丁的化学式是H2OD.反应前后原子的种类、数目没有改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国食盐价格放开,促进盐业改革。食盐氯化钠食盐是日常生活的必需品,图一是家用环保型消毒液发生器示意图,图二是发生反应原理的流程图。

(1)实验室里做溶解实验时,要用玻璃棒不断搅拌,其目的是_______________。
(2)根据图二中的反应原理,电解氯化钠稀溶液的化学方程式为_______________,从能量变化角度看,该反应将___能转化为化学能。
(3)电解含氯化钠2.34 g的饱和食盐水,则可制得氢气的质量是多少______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如右图所示。从图中所获信息不正确的是


A. 反应过程中有热量放出B. 50s时,溶液中溶质为AlCl3
C. 0~50s,发生Al2O3+6HCl===2AlCl3+3H2O反应D. 100—140s,压强减小是因为温度降低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高纯氧化铁(Fe2O3)又称“引火铁”,可作催化剂,在现代工业上有广泛应用前景。以下是用赤铁矿(含少量 SiO2 等杂质)为原料,制备高纯氧化铁的生产流程示意图。
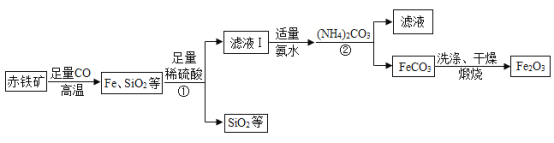
已知:氨水呈碱性(主要成分NH3·H2O是一种碱);(NH4)2CO3溶液呈碱性,40℃以上易分解。
(1)写出高温时赤铁矿中的Fe2O3 与 CO 发生反应的化学方程式_____。
(2)①和②处的操作是_____,这个操作中玻璃棒的作用是_____。
(3)加入(NH4)2CO3 后,该反应必须控制的条件是_____;(NH4)2CO3与FeSO4 发生复分解反应而生成FeCO3,则②处反应的化学方程式为_____。
(4)用蒸馏水洗涤FeCO3 的目的是除去表面附着的杂质,洗涤干净的标志是:取最后一次洗涤液,向其中加入适量的 BaCl2 溶液,无_____(填现象)产生,即为洗涤干净。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com