
分析 根据反应4NO2+O2+2H2O═4HNO3分析加热反应后的气体,对固体加热分解反应后生成的NO2与O2气体分子数比为4:1时,气体通入水中观察到气体全部被吸收,若不满足该分子数比时,则气体通入水中可观察到有气体放出.
解答 解:(1)若该固体是纯净物,且将这些气体通入水中,结果全部被吸收,没有剩余,根据反应4NO2+O2+2H2O═4HNO3,则可判断受热分解反应后生成的NO2与O2气体分子数比为4:1;由KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式,可判断固体纯净物为Cu(NO3)2;
(2)要使固体充分加热得到一定量的气体,将这些气体通入水中,结果全部被吸收,没有剩余,根据反应4NO2+O2+2H2O═4HNO3,则可判断受热分解反应后生成的NO2与O2气体分子数比为4:1;再根据KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式,三种固体物质无论如何进行混合,分解后所得的NO2与O2气体分子数比都不能满足4:1的关系,因此,可判断该固体物质不可能是混合物.
故答案为:(1)Cu(NO3)2;Cu(NO3)2分解所得NO2、O2物质的量之比为4:1,通入水中发生反应:4NO2+O2+2H2O=4HNO3,全部吸收;
(2)只有分解所得NO2、O2系数之比为4:1,通入水中发生反应4 NO2 +O2 +2 H2O═4 HNO3,气体才能全部被吸收.
点评 利用反应的化学方程式判断出反应中各物质的分子(粒子)个数比,此为解答本题的基础,考查了对化学方程式的灵活运用.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:初中化学 来源: 题型:实验探究题
| 假设 | 设计的相关实验操作 | 实验中观察到的现象 | 假设是否成立 |
| ① | 取一定量粉末加入稀盐酸 | 没有气体产生 | 不成立 |
| ② | 取一定量粉末溶于水 | 溶液浑浊且温度升高 | 成立 |
| ③ | 取一定量粉末溶于水,静置后取上层清液再通人二氧化碳 | 没有沉淀产生 | 不成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 液氧是淡蓝色的 | |
| B. | 蓝色的硫酸铜晶体受热变成白色粉末 | |
| C. | 浑浊的石灰水过滤后变为澄清溶液 | |
| D. | 水在通电条件下产生气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
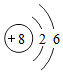 和
和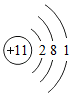 形成的化合物Na2O
形成的化合物Na2O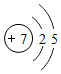 的单质N2
的单质N2查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
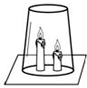 如图所示,将两支燃着的蜡烛罩上茶杯.试回答下列问题:
如图所示,将两支燃着的蜡烛罩上茶杯.试回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
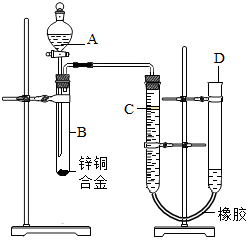 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
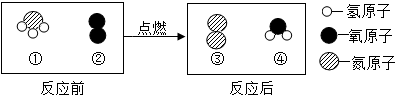
| A. | 反应前后分子个数总和相等 | B. | 反应前后氧元素的化合价不变 | ||
| C. | 图①对应物质的元素质量比为14:3 | D. | 图④对应物质由两种元素组成 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com