
将50g木炭粉与氧化铜组成的黑色固体混合物放入试管中高温加热,待反应完成后,冷却称得剩余固体的质量为39g。试通过计算确定剩余的39g固体的组成。
剩余物的组成:Cu:32g,C:7g或Cu:32g,CuO:7g
解析试题分析:炭粉和氧化铜的黑色固体,加热反应要不恰好反应,要不炭粉过量,要不氧化铜过量,首先根据质量守恒定律,求出生成二氧化碳的质量=50g-39g=11g,再根据化学方程式:C+ 2CuO 高温2Cu + CO2↑中,炭粉、氧化铜与二氧化碳的质量关系,算出发生反应的炭粉、氧化铜的质量,再讨论过量的物质质量
解:设生成铜的质量为x
C+ 2CuO 2Cu + CO2↑
2Cu + CO2↑
128 44
x 50g -39g 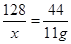
x=32g
剩余物的组成:Cu:32g,C:7g,Cu:32g,CuO:7g
考点:质量守恒定律的应用,根据化学方程式的计算


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:计算题
根据国家规定,酿造食醋的总酸含量标准为
3.5 g/100 mL~5.0 g/100 mL(总酸含量即100 mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0 mL该食醋样品与7.5 g溶质质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品的总酸含量,并说明是否符合国家标准。
(醋酸和氢氧化钠反应的化学方程式:CH3COOH+NaOH=CH3COONa+H2O
假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
2005年5月22日上午11时08分,中国登山测量队成功登上珠峰顶,这是继1975年后我国再次对珠穆朗玛峰高度进行精确测量。氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢氧化钙和氢气:CaH2 + 2H2O = Ca(OH)2 + 2H2↑,氢气供燃烧之需。现有168g氢化钙与足量水反应,可生成多少克氢气?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu 、Fe2O3两种固体中的一种或两种组成。
【提出猜想】红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
【查阅资料】(1)白色无水CuSO4遇水变蓝
(2)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【实验探究】
[甲组同学]:定性检测该红色粉末的物质组成
(1)小云取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液。则猜想 一定不成立,其中一定发生反应的化学方程式为 。
(2)小伟向小云得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到
现象,得出猜想③成立。
[乙组同学]:定量测定该红色粉末中氧化铁的质量分数
实验步骤:小晨称取该红色粉末5.0g装入硬质玻璃管中,按下图进行实验。开始时缓缓通入CO气体,过一段时间后再高温加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
| | 反应前 | 反应后 |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3 g | 玻璃管和固体物质的总质量为47.1 g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6 g | 洗气瓶和瓶中所盛物质的总质量为261.9 g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
下图为某浓盐酸的商标。计算回答下列问题:
(1)某研究小组的同学欲用该盐酸配制50mL7.3%的稀盐酸(此稀盐酸的密度取1.0g/mL),需要该浓盐酸_______g。(计算结果保留整数)
(2)用上述所配制稀盐酸测定氢氧化钠的含量。具体操作是:在被测的一定量的氢氧化钠溶液中逐滴加入上述所配制的稀盐酸,并测量不同时间溶液的pH,记录数据如下表:
| 反应时间(秒) | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
| 滴入稀盐酸体积(mL) | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量。他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如下表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
兴趣小组同学利用图3装置进行相关实验,看到的现象有: ,在这个反应里,被还原的物质是 。计算要使80 g氧化铜完全还原,需要碳的质量至少是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的碱会含有少量的NaCl.某研究性学习小组称取含NaCl的Na2CO3,固体25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8g二氧化碳气体.试计算:(1)原固体中Na2CO3,的质量分数;(2)反应中消耗的盐酸的总质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com