
【题目】仔细阅读某试剂瓶上的标签,并回答下列有关问题:
过氧化氢溶液
[含量]过氧化氢的质量分数为30%
[密度]1.1g/cm3
[性状]无色透明液体;本身不能燃烧,但能与可燃物反应放出大量热量和氧气而引起着火爆炸;过氧化氢在pH为3.5-4.5时较稳定;遇光、热易分解。
[用途]………。
[贮藏]………。。
(1)过氧化氢在_____填(“酸性”、“碱性”或“中性”)溶液中较稳定。
(2)贮藏该过氧化氢溶液时应注意:①避光低温保存;②_____。
(3)若配制100mL3.3%(密度近似为1g/cm3)的过氧化氢溶液,则需要该溶液_____mL。
(4)实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。
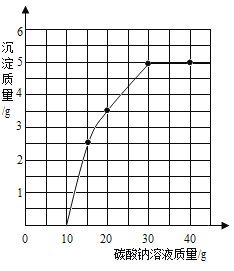
回答下列问题:
①开始加入碳酸钠溶液至10g时,还没有沉淀的原因是_____。
②计算原滤液中氯化钙的质量分数。
【答案】酸性;密封保存;10;滤液中含有盐酸,碳酸钠和盐酸先反应;11.1%
【解析】
(1)过氧化氢在pH为3.5-4.5时较稳定,即过氧化氢在酸性溶液中较稳定。
(2)过氧化氢能与可燃物反应放出大量热量和氧气而引起着火爆炸,遇光、热易分解,贮藏该过氧化氢溶液时应注意:①避光低温保存;②密封保存。
(3)根据溶液稀释溶质质量不变,若配制100mL3.3%(密度近似为1g/cm3)的过氧化氢溶液,则需要该溶液![]() 。
。
(4)①碳酸钠与氯化钙反应会生成碳酸钙沉淀,但碳酸钙与盐酸反应有会生成氯化钙,故开始加入碳酸钠溶液至10g时,还没有沉淀的原因是滤液中含有盐酸,碳酸钠和盐酸先反应。
②设原滤液中氯化钙的质量为x,则
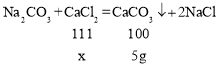
![]()
x=5.55g;
故原滤液中氯化钙的质量分数为:![]() ;
;
答:原滤液中氯化钙的质量分数是11.1%.


科目:初中化学 来源: 题型:
【题目】为了探究某稀盐酸中溶质的质量分数,甲、乙两同学分别取溶质质量分数相等的稀盐酸100g,甲同学向其中加入氧化铜8g,反应结束后观察到固体全部消失;乙同学向其中加入氧化铜16g,反应结束后观察到固体有剩余。下列有关实验的推断不正确的是( )
A.反应后乙同学所得溶液中一定不含盐酸
B.反应后向甲同学所得的溶液中滴加过量氢氧化钠溶液,一定会有蓝色沉淀生成
C.反应后甲、乙两同学所得的溶液中溶质的质量分数不一定相等
D.原稀盐酸中溶质的质量一定大于7.3克小于14.6克
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图中甲、乙分别表示两种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )
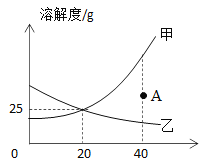
A.图中A点表示甲、乙两种物质在40℃时均达到饱和
B.甲、乙两种饱和溶液,当温度从40℃降至20℃时,一定析出相同质量的晶体
C.将40℃等质量的甲、乙两种饱和溶液降温至20℃后,剩余溶液中的溶剂的质量关系为甲小于乙
D.0℃时,甲、乙具有相同的溶解度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图像分别对应四种操作(或治疗)过程,其中正确的是( )
A. 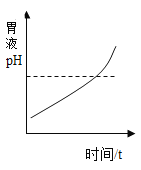 用胃舒平主要成分[主要成分Al(OH)3]治疗胃酸过多时pH变化情况
用胃舒平主要成分[主要成分Al(OH)3]治疗胃酸过多时pH变化情况
B. 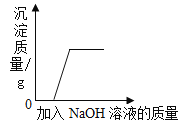 向氯化铁溶液中加入氢氧化钠溶液直至过量
向氯化铁溶液中加入氢氧化钠溶液直至过量
C. 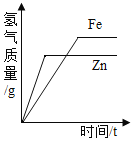 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D. 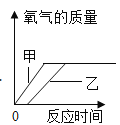 用过氧化氢分解制取氧气:加入二氧化锰(甲)与单独加热(乙)生成氧气的质量
用过氧化氢分解制取氧气:加入二氧化锰(甲)与单独加热(乙)生成氧气的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一种不纯的二氧化碳气体,其中可能混有O2、CO中的一种。现取这种气体4.4克,与炽热的焦炭充分反应后,气体质量增加到5.8克。则混入的气体是( )
A.O2
B.CO
C.二者皆无
D.无法判断
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】关于如图所示的电解水实验,下列说法不正确的是
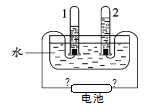
A.收集少量试管1气体移近酒精灯可发出尖锐爆鸣声
B.试管2连接的电池正极一端
C.试管1和试管2中气体的体积比为2:1
D.实验证明水是由氢分子和氧分子构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列化学方程式:
(1)木炭在氧气完全燃烧_____;
(2)用氢氧化钠溶液吸收二氧化硫气体_____;
(3)实验室氯酸钾和二氧化锰共热制氧气_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黑枸杞富含花青素,享有“花青素之王”的美誉。某小组对黑枸杞提取液进行了探究。
I.探究黑枸杞提取液能否充当酸碱指示剂。
(查阅资料)花青素易溶于水,溶液呈紫色。
(实验准备)将3.0 g黑枸杞粉放入30 mL蒸馏水中,充分溶解后制得黑枸杞提取液。
(进行实验)
实验1-1:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
颜色 | 粉红 | 粉红 | 粉红 | 浅紫 | 浅紫 | 紫 | 紫 | 蓝 | 蓝 | 深蓝 | 深蓝 | 灰绿 | 黄 | 黄棕 |
实验1-2:室温时,向试管中分别加入相同体积的6种物质,各滴3滴黑枸杞提取液。实验结果如下:
物质 | 白醋 | 稀盐酸 | 牛奶 | 蒸馏水 | 纯碱水 | 氢氧化钠溶液 |
颜色 | _____ | 粉红 | 紫 | 紫 | 灰绿 | 黄 |
(解释与结论)
(1)若白醋的pH为3,向白醋中滴加黑枸杞提取液后,颜色为______。
(2)根据实验现象,不能确定牛奶呈中性的理由是______。
(3)向纯碱水中加黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为______。
II.探究影响黑枸杞提取液中花青素稳定性的因素。
(查阅资料)利用花青素含量与吸光度大小呈正比的关系,可衡量花青素的含量进而判断花青素的稳定性。
(实验准备)在一定条件下配制出黑枸杞提取液备用。
(进行实验)
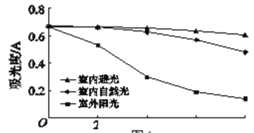
实验2-1:相同温度下,在3支试管中加入相同体积的黑枸杞提取液,分别放置在室内避光、室内自然光和室外阳光的条件下12小时(结果如图)。
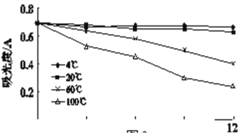
实验2-2:相同光照条件下,在4支试管中加入相同体积的黑枸杞提取液,分别放置在4 ℃、20 ℃、60 ℃、100 ℃的条件下12小时(结果如图)。
(解释与结论)
(4)实验2-1的目的是______。
(5)实验2-2的结论是______。
(反思与评价)
(6)由实验可知,黑枸杞提取液能充当酸碱指示剂,但在保存时应注意______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为 ZnO,还含有 FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
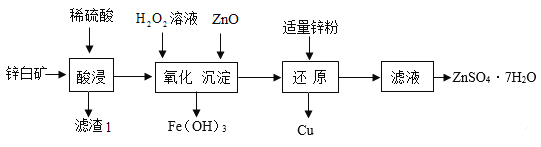
(1)“滤渣Ⅰ”的主要成分是_________(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,② _____(填一种)。
(2)“还原”步骤加入适量锌粉的作用是(用化学方程式表示)_________。
(3)由滤液得到ZnSO4·7H2O的操作依次为蒸发浓缩、 _____、过滤、洗涤、干燥。
(4)实验室中过滤操作需要使用的玻璃仪器有烧杯、漏斗、 _____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com