
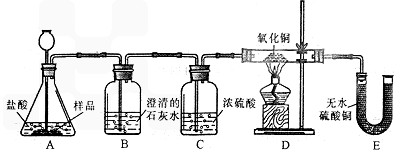
科目:初中化学 来源: 题型:阅读理解
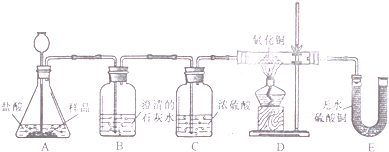
查看答案和解析>>
科目:初中化学 来源:2012届江苏省东台市新曹农场中学初三年级阶段形成性测试化学试卷(带解析) 题型:计算题
(1)(8分)小丽在购买的袋装薯片中发现有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,小丽打算进行实验探究,请你一同参与。
《实验目的》证实灰白色粉末中含有CaCO3和Fe。
《查阅资料》①氢气具有还原性,能夺取某些金属氧化物中的氧,使金属还原,
②白色的无水硫酸铜遇水变成蓝色。
《实验设计》装置如下图所示: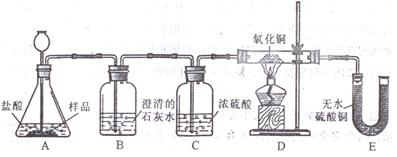
《实验预测与分析》
①若要证实样品中含有CaCO3,B中观察到的实验现象是_____________________,B中发生反应的化学方程式为_____________________。
②若要证实样品中含有Fe,D中应观察到的实验现象是________________________,E中应观察到的实验现象是________________________。
③看了小丽的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式__________________。
④小丽认为棕红色粉末Fe2O3也能与盐酸反应,请你写出反应的化学方程式___________________________。
(2)(5分)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜中铜的质量分数,现取20g该样品粉碎,加入到100g稀硫酸中,恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6克。
①反应生成氢气的质量是__________________,
②黄铜样品中铜的质量分数是_______________,
③计算稀硫酸中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:江苏月考题 题型:实验题
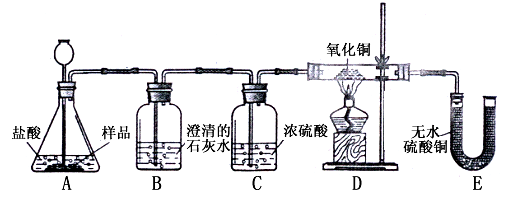
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省盐城市东台市新曹农场中学九年级(下)阶段形成性测试化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com