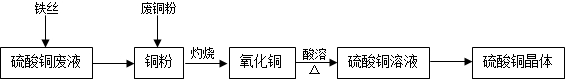
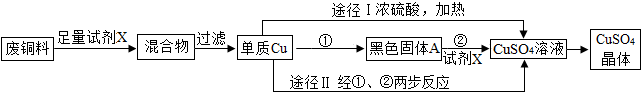
分析:Ⅰ.(1)根据Cu
2+水解产生Cu(OH)
2是吸热反应,加热促进水解,故产生浑浊以及硫酸能和氢氧化铜反应生成硫酸铜和水进行解答;
(2)根据Na
2S溶液和AlCl
3溶液反应生成氢氧化铝沉淀和硫化氢气体进行解答;
(3)加热蒸干至质量不再减少为止,能得到较纯净的原溶质,需要依据溶液中 溶质的水解、分解、氧化等反应,结合生成产物的性质分析判断;如根据NH
4HCO
3受热分解生成氨气、水和二氧化碳;
Ⅱ.(1)高锰酸钾本身呈紫色,无需指示剂,滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点;
根据c(待测)=
判断可知c(待测),推测致测定结果偏低的;
(2)了解配制100mL待测溶液需要的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、100ml容量瓶、胶头滴管;滴定所需要的仪器有:酸式滴定管;锥形瓶;铁架台等,推测答案.
解答:解:Ⅰ.(1)因Cu
2+水解产生Cu(OH)
2,该反应是吸热反应,加热促进水解,故产生浑浊;硫酸浓度增大,平衡逆向移动,能得到澄清的较浓的CuSO
4溶液,
故答案为:Cu
2+水解产生Cu(OH)
2是吸热反应,加热促进水解,故产生浑浊;应加入少量H
2SO
4;
(2)铝离子能与硫离子发生双水解生成氢氧化铝和硫化氢,反应的离子方程式为:2Al
3++3S
2-+6H
2O=2Al(OH)
3↓+3H
2S↑,故答案为:2Al
3++3S
2-+6H
2O=2Al(OH)
3↓+3H
2S↑;
(3)①NH
4HCO
3受热分解,得不到原溶质,故①不符合;
②CaCl
2水溶液经加热浓缩、蒸干灼烧后能得到原溶质物质,故符合;
③AlCl
3溶液水解生成氢氧化铝和氯化氢,氯化氢挥发促进水解得到氢氧化铝,得不到原溶质,故不符合;
④Cu(NO
3)
2溶液中铜离子水解生成氢氧化铜和硝酸,硝酸是难挥发性酸,加热蒸干至质量不再减少为止,蒸干灼烧后能得到氧化铜;故④不符合;
⑤FeCl
2具有还原性加热被氧化为三价铁,而FeCl
3溶液水解生成氢氧化铁和氯化氢,氯化氢挥发促进水解得到氢氧化铁,得不到原溶质,故⑤不符合;
⑥K
2SO
3,蒸干灼烧后被氧化为硫酸钾,故⑥不符合;
⑦KMnO
4加热到质量不变分解生成锰酸钾、二氧化锰和氧气,得不到原溶质,故⑦不符合;
⑧KAl(SO
4)
2水溶液经加热浓缩、蒸干灼烧后能得到原溶质物质,故⑧符合;
综上所述:②⑧符合.
Ⅱ.(1)高锰酸钾本身呈紫色,无需指示剂,滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点,故答案为:滴入最后一滴KMnO
4溶液恰好由黄绿色变浅紫红色,且半分钟内不褪色;
下列操作会导致测定结果偏低的是:
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定,标准液浓度减小,所需v(标准)增大,根据c(待测)=
判断可知c(待测)偏大,故A错误;
B.锥形瓶用蒸馏水洗涤后未用待测液润洗,所需v(标准)不变,根据c(待测)=
判断可知c(待测)不变,故B错误;
C.读取标准液读数时,滴定前平视,滴定到终点后俯视,所需v(标准)偏小,根据c(待测)=
判断可知c(待测)偏小,故C正确;
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失,所需v(标准)偏大,根据c(待测)=
判断可知c(待测)偏大,故D错误;
故选:C;
(2)配制100mL待测溶液需要的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、100ml容量瓶、胶头滴管;滴定所需要的仪器有:酸式滴定管;锥形瓶;铁架台等,故答案为:ABD;
故答案为:Ⅰ.(1)Cu
2+水解产生Cu(OH)
2是吸热反应,加热促进水解,故产生浑浊;应加入少量H
2SO
4;(2)2Al
3++3S
2-+6H
2O=2Al(OH)
3↓+3H
2S↑; (3)②⑧;
Ⅱ.(1)溶液由浅绿色变为紫红色,且半分钟后不变色; C; (2)ABD



 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案