某化学兴趣小组研究某锌粒样品与稀硫酸的反应.取7.5g样品于烧杯中,向其中缓缓加入稀硫酸并搅拌,使其充分反应,至恰好不再产生气体为止,共加入稀硫酸50g.称得烧杯内物质的质量变为57.3g.(假设样品中杂质既不溶于水,也不与酸溶液反应)计算:
(1)生成H2的质量为______g;
(2)计算该7.5g样品中锌的质量和反应后所得溶液中溶质的质量分数.(精确到0.1%)(写出计算过程)
【答案】
分析:锌与稀硫酸反应生成硫酸锌,同时放出氢气;根据质量守恒定律,实验前后烧杯中物质的质量差即为反应放出氢气的质量;而利用锌和稀硫酸反应的方程式依据氢气的质量可以求出生成的硫酸锌和反应的锌的质量,即可求出反应后溶液的溶质质量分数.
解答:解:(1)生成氢气的质量为50g+7.5g-57.3g=0.2g
(2)设样品中锌和生成的硫酸锌的质量分别是x、y
Zn+H
2SO
4=ZnSO
4+H
2↑
65 161 2
x y 0.2g
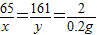
x=6.5g y=16.1g
杂质的质量是7.5g-6.5g=1g 溶液的质量是57.3g-1g=56.3g
反应后所得溶液中溶质的质量分数为:

×100%=28.6%
故答案为:(1)0.2;(2)6.5g;28.6%.
点评:本题主要考查了学生解决有关含杂质物质的化学方程式的计算能力,解题关键是根据质量守恒定律首先求出氢气的质量.

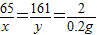
 ×100%=28.6%
×100%=28.6%