
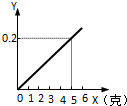
 某不纯的铁粉与稀硫酸反应时,质量关系如图所示,x表示不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )
某不纯的铁粉与稀硫酸反应时,质量关系如图所示,x表示不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )| A. | Ag | B. | Zn | C. | Cu | D. | Mg |
分析 根据铁与硫酸反应的化学方程式可以计算出5.6g纯铁能生成0.2g氢气.由于5g<5.6g,说明不纯的铁中所含的杂质能与盐酸反应且能产生氢气,而且产生等质量的氢气需要该金属的质量小于5g,据此分析.
解答 解:由图象可知5g金属反应最终生成氢气的质量是0.2g;
假设样品为纯铁,需要铁的质量是x,
Fe+H2SO4 ═FeSO4+H2↑
56 2
x 0.2g
$\frac{56}{x}$=$\frac{2}{0.2g}$ x=5.6g>5g,因此产生等质量的氢气需要另一种金属的质量小于5g,银、铜不能反应,
假设样品为纯锌,需要锌的质量是x,
Zn+H2SO4 ═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}$=$\frac{2}{0.2g}$ x=6.5g>5g,不符合,
假设样品为纯镁,需要镁的质量是x,
Mg+H2SO4 ═MgSO4+H2↑
24 2
x 0.2g
$\frac{24}{x}$=$\frac{2}{0.2g}$ x=2.4g<5g,符合,
故选项为:D.
点评 本题的关键是所含杂质:能与盐酸反应、能产生氢气、与铁的质量相等时比铁产生的氢气多.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 打开盛有浓硫酸的试剂瓶瓶盖,瓶口上方出现大量白雾 | |
| B. | 硫在空气中燃烧产生明亮的蓝紫色火焰 | |
| C. | 向氢氧化钠溶液中滴加无色酚酞试液,溶液的颜色由无色变成红色 | |
| D. | 碳和氧化铜在高温条件下反应,生成黑色的铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com