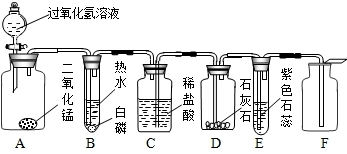
解:(1)过氧化氢在二氧化锰的作用下生成水和氧气,方程式为:2H
2O
2
2H
2O+O
2↑;
(2)通入氧气后,白磷与氧气接触,温度达到白磷的着火点,使白磷具备了燃烧的三个条件,所以燃烧了;
(3)氧气不与盐酸反应,所以氧气把盐酸从C装置压人D装置,与石灰石反应,产生气泡,反应的方程式为:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
(4)多余的二氧化碳进入E装置与水反应产生碳酸,使紫色的石蕊试液变成红色;反应的方程式为:CO
2+H
2O═H
2CO
3(5)因为二氧化碳的密度比空气大,所以可以采用向上排空气法收集;
(6)根据坐标读出生成 2.2g二氧化碳,根据化学方程式的计算可以计算出氯化氢的质量,再计算出盐酸中溶质的质量分数.
解:设稀盐酸中溶质HCl的质量为X
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
2×36.5 44
X 2.2g
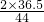
=

X=3.65 g
稀盐酸中溶质HCl的质量分数为:
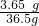
×100%=10%
答:稀盐酸中溶质HCl的质量分数为10%.
故答案为:(1)2H
2O
2
2H
2O+O
2↑
(2)与氧气接触,温度达到着火点.
(3)C中液体进入D中,有气泡产生; CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
(4)导管口有气泡冒出,溶液由紫色变红色; CO
2+H
2O═H
2CO
3(5)气体的密度比空气密度大
(6)解:设稀盐酸中溶质HCl的质量为X
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
2×36.5 44
X 2.2g
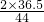
=

X=3.65 g
稀盐酸中溶质HCl的质量分数为:
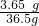
×100%=10%
答:稀盐酸中溶质HCl的质量分数为10%.
分析:(1)过氧化氢在二氧化锰的作用下生成水和氧气;
(2)根据燃烧的条件分析:与氧气接触、温度达到着火点;
(3)盐酸在氧气的作用下被压进D中,与石灰石反应;
(4)根据二氧化碳与水反应生成碳酸能使石蕊试液变成红色分析;
(5)二氧化碳的密度比空气大,采用向上排空气法收集;
(6)读图,根据二氧化碳的质量计算氯化氢的质量,再根据溶质质量分数的公式计算.
点评:本题考查了气体的制取及有关的性质,属于基础性的考查,注意在根据化学方程式计算时要严格按照步骤计算.


 2H2O+O2↑;
2H2O+O2↑;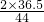 =
= X=3.65 g
X=3.65 g 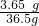 ×100%=10%
×100%=10%  2H2O+O2↑
2H2O+O2↑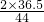 =
= X=3.65 g
X=3.65 g 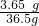 ×100%=10%
×100%=10%