
| 溶质质量 |
| 溶液质量 |
| 98 |
| x |
| 2 |
| 0.4g |
| 溶质质量 |
| 溶液质量 |
| 19.6g |
| 100g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
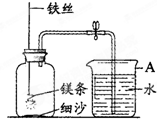 某校研究性学习小组发现镁条在空气中燃烧的产物也为固态,想用镁条代替红磷测定空气中氧气的含量,用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,发现进入集气瓶中水的体积约占集气瓶容积的70%.
某校研究性学习小组发现镁条在空气中燃烧的产物也为固态,想用镁条代替红磷测定空气中氧气的含量,用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,发现进入集气瓶中水的体积约占集气瓶容积的70%.| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:永春县质检 题型:问答题
查看答案和解析>>
科目:初中化学 来源:2010年福建省泉州市永春县初中学业质量检查化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com