
【题目】下列各物质中,不能用金属与盐酸反应直接制取的是( )
A.ZnCl2B.FeCl3C.AlCl3D.MgCl2
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:初中化学 来源: 题型:
【题目】南开大学叶萌春教授及其团队首次实现烯丙醇(C3H6O)高效、绿色合成。烯丙醇是生产香料和化妆品的中间体。下列关于烯丙醇说法正确的是
A.属于氧化物
B.相对分子质量为58g
C.碳元素和氧元素的质量比为9:4
D.烯丙醇分子由3个碳原子、6个氢原子、1个氧原子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用如图所示的简易净水器处理浑浊的河水,下列分析正确的是( )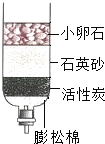
A.净化后的水属于纯净物
B.该净水器能将硬水变为软水
C.该净水器能杀菌消毒
D.用活性炭可以除去水中的色素和异味
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是与水有关的3个实验,请回答下列问题: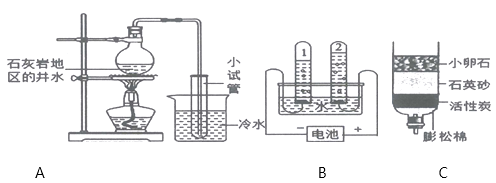
(1)向实验A中的小试管收集的水中加入少量肥皂水,振荡,产生的现象是;
(2)实验B中试管1内气体的化学式为 , 该实验的化学方程式为:
(3)实验C中小卵石、石英沙的作用是。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初三化学上册课本开设了多个学生探究实验活动.在复习课上,宋老师列“探究燃烧的条件”和“催化剂的作用”这两个实验进行了重点复习.请回答下列问题:
(1)关于探究燃烧条件的实验
①2013年12月广州建业大厦发生严重火灾.从燃烧条件分析。大厦内存放的大量鞋、纸箱等物品充当了 . 高层建筑同城设计了灭火的洒水系统.从灭火原理分析,洒水的作用主要是 .
②分析表中的数据,回答问题:
物质代号 | L | M | N | P |
熔点/℃ | -117 | 3550 | 660 | -259 |
沸点/℃ | 78 | 4827 | 2519 | -253 |
着火点/℃ | 510 | 370 | 550 | 580 |
有人认为“物质的熔、沸点越高,着火点越高”,该结论——(填“合理”或“不合理”).已知酒精灯火焰的温度约为500。C.利用如图装置,为验证温度达到可燃物着火点是燃烧条件之一,表中可用于完成该实验的两种可燃物是和(填代号);
(2)关于探究催化剂作用的实验:氯酸钾分解除了用二氧化锰外,还可以氧化铜等物质作催化剂.
【提出问题】氧化铜是否比二氧化锰的催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】以生成等体积的氧气为标准,设计了下列几组实验(其他可能影响实验的因素均忽略).
实验序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
一 | 2.0g | / | 330oC | 100mL | t1 |
二 | 2.0 g | CuO 0.5g | 330oC | 100mL | t2 |
三 | 2.0g | MnO2 0.5g | 330℃ | 100mL | t3 |
四 | 2.0g | MnO2………..g | 380℃ | 100mL | t4 |
①若t1t2(填“大于”“等于”“小于”),说明氧化铜能加快氯酸钾的分解速率.
②你认为设计实验三和实验二对比的目的是:
③写出实验二中所涉及的化学方程式为;
④将实验三和实验四对比,可得出化学反应快慢与温度的关系,那么实验四中控制MnO2的质量应为g;若t3>t4 , 则化学反应快慢与温度的关系是
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验现象描述正确的是
A.镁条在空气中燃烧,发出耀眼白光,生成黑色固体
B.木炭在空气中燃烧时生成二氧化碳
C.向面包片上滴加几滴碘水后呈现蓝色
D.向硫酸铜溶液中滴加澄清石灰水,出现白色沉淀
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】庆典中释放的气球,是由可降解材料制成的,最终会慢慢分解,不会造成污染。
(1)气球降解的过程属于_______ (“化学”或“物理”)变化
(2)气球能够飞上天是因为其中填充了氦气,这里不用氢气的原因是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“氯碱工业”是我国目前化学工业的重要支柱之一,它的主要原理是电解饱和食盐水,其化学方程式为:xNaCl+2H2O ![]() xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
请分析并计算回答:
(1)运用质量守恒定律可知上述反应中x= .
(2)通过计算,上述过程中同时产生H2的质量为 g .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com