
| 20g-7.5g |
| 20g |
| 100 |
| 73 |
| 5g |
| x |
| 3.65g |
| 20g |


科目:初中化学 来源: 题型:
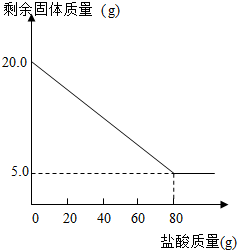
| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| ① | 20 | 16.25 |
| ② | 40 | 12.50 |
| ③ | 60 | M |
| ④ | 80 | 5.00 |
| ⑤ | 100 | 5.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:
某兴趣小组的同学为测定某石灰石中碳酸钙(假设:石灰石中的杂质不与盐酸反应)的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸100g,分5次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| ① | 20 | 16.25 |
| ② | 40 | 12.50 |
| ③ | 60 | m |
| ④ | 80 | 5.00 |
| ⑤ | 100 | n |
查看答案和解析>>
科目:初中化学 来源: 题型:
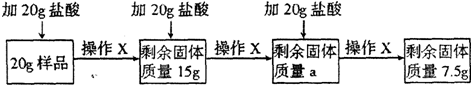
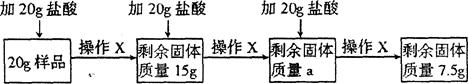
(8分)某兴趣小组的同学为分析一种石灰石样品中碳酸钙的质量分数,取20g样品放入烧杯,把60g稀盐酸分三次加入烧杯,使其充分反应(样品中所含杂质既不溶于水也不与稀盐酸反应),实验流程及数据如下(所有实验数据都不包括烧杯的质量,且不考虑H2O和HCl的挥发;操作X包括搅拌、过滤、洗涤、干燥、称量):
请回答:
(1)CaCO3中Ca与C的质量比为 ;
(2)实验时判断已充分反应的现象是 :其中a为 g;样品中碳酸钙的质量分数为 ;
(3)第三次反应过滤后所得溶液的pH 7(填“>”、“<”或“=”);为使该溶液
显中性且得到尽可能多的CaCl2,最后可向烧杯中加入过量的 (填序号)
A.CaO B.CaCO3 C.Ca(OH)2 D.CaCl2
(4)计算所用稀盐酸中溶质的质量分数(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
| A.CaO | B.CaCO3 | C.Ca(OH)2 | D.CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com