

分析 利用金属活动性顺序判断金属是否与酸反应、金属是否能与盐溶液的反应.另外,还得知道结晶是从溶液中得到溶质的一种办法.
解答 解:(1)在金属活动性顺序中,铜、银排在氢的后面,所以不能与酸反应放出氢气,由题意可知三种金属中只有A能与稀硫酸反应生成无色气体和A的盐溶液,所以我们判断A是Mn;金属B、C的混合物加入足量的含硝酸银的回收液中,过滤后得到金属C,说明金属C不能与硝酸银溶液反应,金属B能与硝酸银溶液反应,得知金属B的活动性大于金属C的活动性,又因为在金属活动性顺序中,铜排在银的前面,所以B是Cu,C是银.所以A、B、C三种金属的活动性顺序为:A>B>C;
(2)由上述分析可知,C是银,要想从A的盐溶液中得到A的硫酸盐晶体,我们可以采用蒸发结晶的方法;
(3)由上述分析可知,A是锰,锰在硫酸盐中锰元素显+2价,锰排在氢前面,能与硫酸反应生成硫酸锰和氢气,化学方程式是:Mn+H2SO4═MnSO4+H2↑.
故答为:(1)A,B,C;(2)银,蒸发结晶;(3)Mn+H2SO4═MnSO4+H2↑.
点评 此题以实验设计流程的形式让学生去利用金属活动性顺序表解决有关金属化学性质的问题,有一定的深度和广度.


科目:初中化学 来源: 题型:推断题
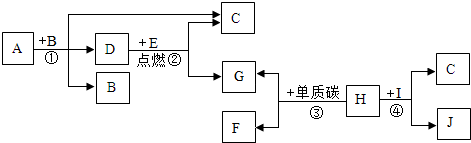
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 373 | 37.8 |
| NH4Cl | 29.4 | 33.3 | 372 | 41.4 | 45.8 | 50.4 | 55.0 | 60.2 | |
| NaOH | 42 | 51 | 109 | 119 | 129 | 145 | 174 | 299 | |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水是生命之源,生活中净化水的方法很多.
水是生命之源,生活中净化水的方法很多.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A | B | C | D |
| 氧化铜和氧化铁 | 氯化钠和氢氧化钙 | 铜、汞、银、金 | 氢气和一氧化碳 |
| 某些金属氧化物能和酸反应生成盐和水 | 一般固体物质的溶解度随温度的升高而增大 | 常温下金属一般为固态 | 某些非金属单质可以将金属从其氧化物中还原出来 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)甲同学实验室发现了如图1所示的溶液颜色变化,图中“→”表示能转化(部分反应物、生成物以及反应条件省略,下同)请回答:
(1)甲同学实验室发现了如图1所示的溶液颜色变化,图中“→”表示能转化(部分反应物、生成物以及反应条件省略,下同)请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| t/℃ | NaOH | Na2CO3 | NaCl |
| 0 | 42 | 7.1 | 35.7 |
| 10 | 51 | 12.2 | 35.8 |
| 20 | 109 | 21.8 | 36.0 |
| 30 | 119 | 39.7 | 36.3 |
| NaOH | Na2CO3 | NaCl |
| 17.3 | <0.01 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com