
科目:初中化学 来源: 题型:
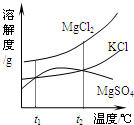 我市濒临渤海,有较长的海岸线,海洋资源十分丰富.
我市濒临渤海,有较长的海岸线,海洋资源十分丰富.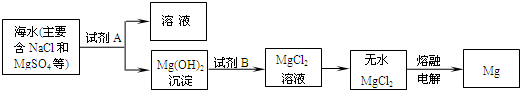
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
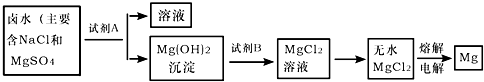
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:江苏省淮安市2007年初中毕业暨中等学校招生文化统一考试化学试题 题型:038
我市有丰富的NaCl矿产资源,NaCl是一种重要的化工原料,可以用于生产烧碱、氯气等重要的化工产品.某化工厂购进一批以NaCl为主要成分的原料(假设杂质全部为CaCl2),化验员欲测定原料中NaCl的质量分数,先称取60.0 g样品,加足量水充分溶解后,向所得溶液中加入足量的溶质质量分数为10%的Na2CO3溶液,充分反应后,生成2.0 g白色沉淀.(已知:CaCl2+Na2CO3![]() 2NaCl+CaCO3↓)
2NaCl+CaCO3↓)
试回答下列问题(写出计算过程):
(1)原料中NaCl的质量分数是多少?
(2)当恰好完全反应时,需Na2CO3溶液的质量是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com