
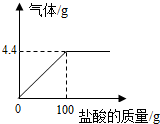
 在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,生成气体的质量与所加稀盐酸的质量关系如图所示.计算:
在含氯化钠杂质的纯碱13.6g中逐渐加入质量分数为7.3%稀盐酸,生成气体的质量与所加稀盐酸的质量关系如图所示.计算:分析 根据溶质质量=溶液质量×溶液的溶质质量分数解答;
根据碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,由生成二氧化碳气体的质量,由反应的化学方程式计算出生成氯化钠的质量、参加反应的碳酸钠的质量.
解答 解:
(1)100g稀盐酸中氯化氢的质量=100g×7.3%=7.3g;
碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,生成二氧化碳气体的质量为4.4g
设生成氯化钠的质量为x,参加反应的碳酸钠的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
y x 4.4g
$\frac{106}{y}=\frac{117}{x}=\frac{44}{4.4g}$
y=10.6g
x=11.7g
(2)13.6g纯碱中氯化钠的质量=13.6g-10.6g=3g;
(3)完全反应后,所得溶液中溶质的质量分数=$\frac{11.7g+3g}{13.6g+100g-4.4g}×$100%≈13.5%
答案:
(1)100g稀盐酸中氯化氢的质量为7.3g;
(2)13.6g纯碱中氯化钠的质量3g;
(3)完全反应后,所得溶液中溶质的质量分数为13.5%.
点评 要想解答好这类题目,要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等,难度不大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:初中化学 来源: 题型:解答题
 实验室贮存的烧碱易变质,围绕变质问题某学习小组同学取实验室放置了一段时间的烧碱固体样品进行下列探究,过程如下,请回答相关问题:
实验室贮存的烧碱易变质,围绕变质问题某学习小组同学取实验室放置了一段时间的烧碱固体样品进行下列探究,过程如下,请回答相关问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②④⑤ | C. | ①②③④ | D. | ①③④⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若固体粉末质量为9克,则混合物的可能组成有2种 | |
| B. | 若固体粉末质量为10克,则混合物一定由CaCO3和KHCO3组成,且质量比一定为1:1 | |
| C. | 若固体粉末质量为8.4克,则混合物一定由MgCO3和NaHCO3组成,质量比可能为2:1 | |
| D. | 若无论组成成分质量如何变化,固体粉末质量为一定值,则固体一定由MgCO3和NaHCO3组成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质可由分子、原子或离子构成 | |
| B. | 结构示意图为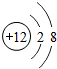 、 、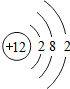 的粒子,表示了同种元素不同的粒子 的粒子,表示了同种元素不同的粒子 | |
| C. | 相对原子质量为m的原子M,核外有n个电子,则核内中子数为:m-n | |
| D. | 原子序数为16的原子,位于周期表中第2周期 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | KNO3溶液 | K2SO4 | 加适量Ba(NO3)2溶液,充分反应后,过滤 |
| B | FeCl2溶液 | HCl | 加过量铁粉,充分反应后,过滤 |
| C | NaCl固体 | MnO2 | 加水溶解、过滤、蒸发结晶 |
| D | O2 | CO | 通过灼热的氧化铜粉末 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
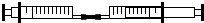 饮用可乐时,小华对“二氧化碳的溶解性”产生了兴趣,并进行了探究.
饮用可乐时,小华对“二氧化碳的溶解性”产生了兴趣,并进行了探究.| 实验编号 | 抽取气体的体积 | 抽取蒸馏水的体积 | 充分混合后,气、液总体积 |
| ① | 10mL空气 | 10mL | 20mL |
| ② | 10mL现制的二氧化碳 | 10mL | 12mL |
| 操作步骤 | 实验现象 | 实验结论 |
| 将气体推至一注射器内,气液分离,取下盛有液体的注射器并挤出液体,重新抽取一定体积的蒸馏水,再将两注射器连接,反复交替推动活塞. | ①气体体积减少(总体积减少),②若气体体积不变(总体积不变). | ①实验结论可信②实验结论不可信. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
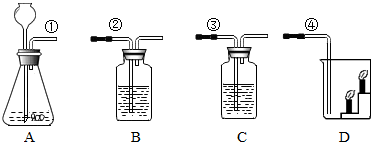 实验室按如图所示装置制取CO2,并检验CO2的性质.试回答以下问题:
实验室按如图所示装置制取CO2,并检验CO2的性质.试回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com