
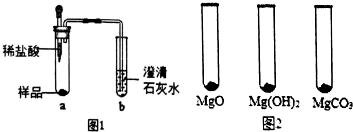
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
分析 (1)镁能和稀盐酸反应生成氯化镁和氢气,氧化镁能和稀盐酸反应生成氯化镁和水,氢氧化镁和稀盐酸反应生成氯化镁和水,碳酸镁和稀盐酸反应生成氯化镁、水和二氧化碳;
二氧化碳不能燃烧,不支持燃烧;
通常情况下,氢氧化钙的溶解度很小,氢氧化钠的溶解度很大;
点燃条件下,氢气能够在空气中燃烧,发出淡蓝色火焰;
(2)根据“镁粉”消耗稀盐酸的体积可以初步判断“镁粉”的组成;
根据0.5g“镁粉”和0.5gMgCO3与足量稀盐酸反应生成气体的体积可以计算“镁粉”中含有MgCO3的质量分数.
解答 解:(1)①b试管中澄清石灰水变浑浊,说明反应生成了二氧化碳,则证明“镁粉”中一定含有MgCO3.
故填:MgCO3.
②将图中的澄清石灰水替换成浓NaOH溶液,目的是把二氧化碳全部吸收;
按照修改后的实验方案重复上述实验,二氧化碳被氢氧化钠溶液全部吸收后,观察到b试管口仍然无明显现象,证明“镁粉”中没有Mg.
故填:把二氧化碳全部吸收;没有Mg.
(2)Mg(OH)2与盐酸发生中和反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O;
“镁粉”不只含有MgCO3.理由是:0.5g“镁粉”消耗稀盐酸的体积与0.5gMgCO3消耗稀盐酸的体积不相等;
为确定“镁粉”的具体成分,还需要补充如下实验:分别取0.5g“镁粉”和0.5gMgCO3加入足量稀盐酸;
设0.5g“镁粉”的质量为x,
因为测定生成的气体体积分别为119ml和140ml,说明0.5g“镁粉”和0.5gMgCO3中,碳酸镁的质量比是119:140,
根据题意有:$\frac{x}{0.5g}=\frac{119}{140}$,
x=0.425g,
由此可知“镁粉”中含有MgCO3的质量分数为:$\frac{0.425g}{0.5g}$×100%=85%.
故填:Mg(OH)2+2HCl═MgCl2+2H2O;0.5g“镁粉”消耗稀盐酸的体积与0.5gMgCO3消耗稀盐酸的体积不相等;MgCO3;85%.
点评 相同条件下,气体的体积比等于气体的物质的量之比,物质的量之比等于物质的质量比,因此知道了生成的气体体积分别为119ml和140ml,就能够计算相关方面的问题了,要注意理解.


科目:初中化学 来源: 题型:实验探究题
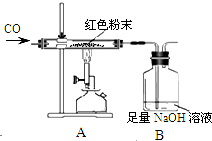 某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验室常用于制取氧气的方法有:a加热氯酸钾晶体和二氧化锰粉末;b加热高锰酸钾固体;c用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生水和氧气.
实验室常用于制取氧气的方法有:a加热氯酸钾晶体和二氧化锰粉末;b加热高锰酸钾固体;c用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生水和氧气.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.3%NaCl溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com