
 学习完“酸、碱、盐的性质”后,老师将两瓶未贴标签的饱和石灰水、饱和碳酸钠溶液分别标记为甲、乙.请你和同学们一起完成探究过程:
学习完“酸、碱、盐的性质”后,老师将两瓶未贴标签的饱和石灰水、饱和碳酸钠溶液分别标记为甲、乙.请你和同学们一起完成探究过程:| 实验操作 | 实验现象 |
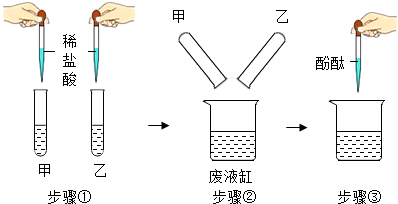 | 步骤①:甲溶液中观察到现象A, 乙溶液中无明显现象 步骤②:底部有白色沉淀 步骤③:上层为无色透明的溶液 |
分析 (1)根据碳酸钠属于盐解答;
(2)稀盐酸与碳酸钠反应有气泡产生,稀盐酸与氢氧化钙反应无明显现象解答;
(3)根据②底部有白色沉淀,说明碳酸钠有剩余,与氯化钙反应生成碳酸钙沉淀和氯化钠解答;
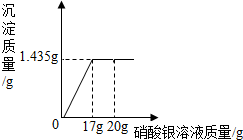
(4)观察图象可知,沉淀的质量的最大值是1.435克,然后写出化学方程式并代入沉淀的质量计算出硝酸银的质量,最后计算出溶液中溶质的质量分数.
解答 解:(1)碳酸钠属于盐类物质,其水溶液显碱性.
(2)现象A是有气泡产生,则甲溶液是碳酸钠,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.该反应属于基本反应类型中的复分解反应;稀盐酸与氢氧化钙反应生成氯化钙和谁,步骤①乙溶液中溶质一定有氯化钙;
(3)②底部有白色沉淀,说明碳酸钠有剩余,与氯化钙反应生成碳酸钙沉淀和氯化钠,根据步骤③实验现象则上层溶液中一定含有的溶质是氯化钠,可能含有的溶质是氯化钙,为验证可能含有的溶质,应该补充的实验操作是取样,滴加碳酸钠溶液,若有白色沉淀,则证明有氯化钙;
(4)根据图象可知,当加入15克硝酸银溶液时,沉淀的质量达到最大值(1.435克),设需要硝酸银的质量是x.
NaCl+AgNO3═NaNO3+AgCl↓
170 143.5
x 1.435g
$\frac{170}{x}=\frac{143.5}{1.435g}$
x=1.7g
该硝酸银溶液溶质的质量分数为:$\frac{1.7g}{17g}×$100%=10%
答案:
(1)盐;
(2)碳酸钠;Na2CO3+2HCl═2NaCl+H2O+CO2↑;复分解反应;氯化钙
(3)氯化钠;氯化钙;取样,滴加碳酸钠溶液;
(4)10%.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.学会根据实验现象分析并判断物质种类是解决本题的关键.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:初中化学 来源: 题型:解答题
 水和溶液与人类生存和发展密切相关.
水和溶液与人类生存和发展密切相关.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素属于氧化物 | |
| B. | 青蒿素中碳元素的含量最高 | |
| C. | 青蒿素中碳、氢和氧三种元素的质量比为15:22:25 | |
| D. | 青蒿素由15个碳原子、5个氧原子和22个氢原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ④⑥ | B. | ②④⑥ | C. | ② | D. | ①③⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
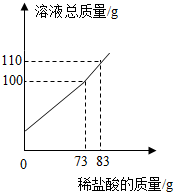 某纯碱样品中含少量氯化钠,称取11g样品于烧杯中,加20.4g的水将其全部溶解,再逐滴加入一定质量分数的稀盐酸并振荡,实验过程中,测得加入稀盐酸的质量和溶液总质量的关系如图所示,计算(写出计算过程):
某纯碱样品中含少量氯化钠,称取11g样品于烧杯中,加20.4g的水将其全部溶解,再逐滴加入一定质量分数的稀盐酸并振荡,实验过程中,测得加入稀盐酸的质量和溶液总质量的关系如图所示,计算(写出计算过程):查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com